遭遇大事件,銀杏葉制劑市場大洗牌
日期:2015/7/13
全國中成藥代理企業副總王曉明向我吐槽:最近累的跟狗似的!國家藥監總局要求2周內將其代理銷售的銀杏葉片全部召回!由于他們是醫院終端銷售為主,涉及面廣而雜,全國20多個省市涉及,商業公司多達500多家,終端醫院更是多達2萬多家,由于醫院還要通知和告知患者召回,企業召回滯后,留給企業的時間也就只有1周,費了九牛二虎之力,二十多萬盒銀杏葉片才得以陸陸續續回收入庫、封存,等待藥監局檢查。“這回鬧大了!這個品種放棄銷售都還沒啥,如果擴大到其他中成藥的自查自糾,甚至嚴重到導致大部分中成藥企業停產整頓,那損失就大了,今年是招標大年,本來想借機賺的盆滿缽滿,沒想到當頭一棒!”說到這,王總狠狠地抽了一口煙,吐了個大大的煙圈:“提取類中成藥風險越來越高,越來越玩不起了!”
力度之大,前所未有!連發13道文件----銀杏葉提取物事件回放
1、2014年7月29日《食品藥品監管總局關于加強中藥生產中提取和提取物監督管理的通知》:發布《中藥提取物備案管理實施細則》,自2016年1月1日起,凡不具備中藥提取能力的中成藥生產企業,一律停止相應品種的生產。《通知》還提出了備案要求:備案成功的植提企業應按照藥品《藥品生產質量管理規范》(GMP)要求組織生產。同時,對中成藥生產企業的外采進一步監管,對屬于備案管理的中藥提取物,可自行提取,也可購買使用已備案的中藥提取物;對不屬于備案管理的中藥提取物,應自行提取。自2016年1月1日起(距離生效時間,尚有半年過渡期),中成藥生產企業一律不得購買未備案的中藥提取物投料生產。
2、2015年5月19日《國家食品藥品監督管理總局關于桂林興達藥業有限公司等企業違法生產銷售銀杏葉藥品的通告(2015年第15號)》:桂林興達藥業有限公司將銀杏葉提取生產工藝違法;同時從不具備資質的企業購進以鹽酸工藝生產的銀杏葉提取物,并用違法原料違法生產銀杏葉片,并將外購的提取物原料銷售給其他的24家藥品生產企業。萬邦德(湖南)天然藥物有限公司違法生產杏葉片和銀杏葉膠囊等制劑。同時要求所有銀杏葉提取物和銀杏葉制劑生產企業自查,一旦違法應立即停止違法生產行為,召回已銷售的產品,封存所有設備、原料、庫存產品及相關記錄。
3、2015年5月20日《食品藥品監管總局關于開展銀杏葉藥品專項治理的通知》:要求所有涉事企業立即采取停售、召回;對銀杏葉提取物和銀杏葉制劑生產企業進行全面檢查,并對市場上的銀杏葉制劑進行全面抽驗,并對部分企業飛行檢查。
4、2015年5月23日《藥監總局副局長吳湞在銀杏葉藥品專項治理工作會議上的講話》:這兩家企業的行為已經嚴重違反《藥品管理法》有關規定和《中國藥典》關于銀杏葉提取物的標準要求,有些行為已經涉嫌犯罪。用鹽酸工藝提取銀杏葉提取物,會造成藥品有效成分的分解,雖然尚未發現對人體有害,但是嚴重影響藥品的療效。老百姓吃了藥卻不治病,耽誤了治療,也是危害公眾健康。所以說這次飛行檢查發現的問題,性質惡劣、危害很大。這是一起典型的為降低成本鋌而走險,主觀故意弄虛作假,使用假劣原料生產藥品的違法行為。市場監測發現,這不是個別企業的問題,還有一些企業也存在類似問題。近日,中檢院從北京市的市場上抽取了14家企業的22個銀杏葉藥品,采用新研究的補充檢驗方法進行了檢驗,發現7家企業的10個產品均不同程度存在改變生產工藝、違法添加相關物質等問題。這已經提示我們,當前銀杏葉藥品生產中存在的問題可能是系統性風險。
5、2015年5月28日《食品藥品監管總局關于切實做好銀杏葉藥品召回工作的通知》:要求進一步加快銀杏葉藥品召回進度。醫療機構和零售藥店等流向終端必須無條件下架、召回。對消費者個人手中持有的應召回藥品,原銷售單位必須無條件回收,并全額退款。在6月3日前全部召回到位。
6、2015年5月29日中共中央政治局就健全公共安全體系進行第二十三次集體學習。習近平強調,要用最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責,加快建立科學完善的食品藥品安全治理體系。《國家食品藥品監督管理總局關于寧波立華制藥有限公司違法銷售銀杏葉藥品及有關企業治理情況的通告》:查處寧波立華制藥有限公司,從不具備資質的企業購進部分批次銀杏葉提取物,銷售給3家藥品生產企業。
7、2015年5月31日《食品藥品監管總局關于進一步做好銀杏葉藥品專項治理的通知》:鼓勵企業自查上報、主動召回存在風險的產品。召回不徹底將依法從嚴處理。
8、2015年6月4日《國家食品藥品監督管理總局關于發布銀杏葉藥品補充檢驗方法的公告》:中國食品藥品檢定研究院研究制定的《銀杏葉提取物、銀杏葉片、銀杏葉膠囊中游離槲皮素、山柰素、異鼠李素檢查項補充檢驗方法》。除了檢測總黃酮醇苷和萜類內酯之外,增加槲皮素、山柰素、異鼠李素的含量測定。
9、2015年6月8日《食品藥品監管總局關于做好銀杏葉提取物和銀杏葉藥品檢驗的通知》:對所有企業自2014年1月1日后生產的所有批次銀杏葉提取物、銀杏葉片和銀杏葉膠囊逐批進行檢驗(包括已召回批次和未召回批次),凡檢驗不合格的,企業應當立即停止生產、銷售和使用,并召回已上市產品。對其他劑型的銀杏葉藥品以及可能存在的其他質量風險,督促企業自查自糾。企業對2014年1月1日后生產的所有批次銀杏葉藥品生產情況和銷售流向全面上報到藥監局。
10、2015年6月10日《食品藥品監管總局辦公廳關于對使用銀杏葉提取物生產保健食品的企業開展執法檢查的通知》:對所有保健品企業自2014年1月1日后生產的所有批次銀杏葉提取物、銀杏葉片和銀杏葉膠囊逐批進行檢驗(包括已召回批次和未召回批次),凡檢驗不合格的,企業應當立即停止生產、銷售和使用,并召回已上市產品。對其他劑型的銀杏葉藥品以及可能存在的其他質量風險,督促企業自查自糾。企業對2014年1月1日后生產的所有批次銀杏葉藥品生產情況和銷售流向全面上報到藥監局。
11、2015年6月12日《食品藥品監管總局關于開展銀杏葉藥品專項監督抽驗的通知》:在北京、吉林、江蘇、廣東、四川、陜西等6省(市)開展銀杏葉藥品專項監督抽驗2014年1月1日之后生產的產品。
12、2015年6月22日《國家食品藥品監督管理總局關于90家銀杏葉提取物和銀杏葉藥品生產企業自檢情況的通告》、《食品藥品監管總局關于落實食品藥品監管總局24號通告要求做好不合格銀杏葉藥品召回及相關工作的通知》:90家銀杏葉提取物、銀杏葉片(含分散片)和銀杏葉膠囊生產企業,對本企業自2014年1月1日以來生產的所有批次銀杏葉提取物、銀杏葉片(含分散片)和銀杏葉膠囊產品45%不合格,不合格企業55家,合格企業45家。所有不合格藥品必須于2015年6月30日前全部召回。
13、2015年7月2日《關于公布銀杏葉藥品專項監督抽驗初步結果的通告》、《食品藥品監管總局關于落實2015年第25號通告做好不合格銀杏葉藥品核查及召回工作的通知》:北京、吉林、江蘇、廣東、四川、陜西等6省(市)不合格產品占23.6%,涉及24家藥品生產企業。點名批評黑龍江天宏藥業股份有限公司等4家企業;點名批評安徽圣鷹藥業有限公司等13家企業召回不力。對召回不力的企業將依法從嚴查處。
銀杏葉類都有哪些產品?有哪些產品涉案?
1、藥品:銀杏葉類共有銀杏葉酊、銀杏葉口服液、銀杏蜜環口服溶液、復方銀杏通脈口服液、銀杏葉丸、銀杏葉滴丸、銀杏葉片、銀杏葉分散片、銀杏葉顆粒、銀杏葉膠囊、銀杏葉軟膠囊、銀杏達莫注射液、銀杏葉提取物注射液、舒血寧注射液、銀杏二萜內酯葡胺注射液、銀杏內酯注射液等139個批文。這次涉案產品主要以口服產品為主。
2、保健品:國內保健食品原料含銀杏葉提取物批準文號共166個。銀杏葉提取物的應用很普遍,保健品里廣泛存在。這次涉及的產品是無錫健特藥業有限公司黃金牌血康膠囊(主要原料:紅曲粉、銀杏葉提取物、丹參提取物、淀粉。);武漢名實生物醫藥科技有限責任公司名實牌金芯寶膠囊(主要原料:葡萄籽提取物、大豆卵磷脂、葛根、銀杏葉、沙棘)、養延牌天韻膠囊(主要原料:覆盆子、葛根、銀杏葉、大豆異黃酮、生物碳酸鈣、乙二胺四乙酸鐵鈉、葡萄籽提取物)、名實牌杏明膠囊(主要原料:山楂、銀杏葉、決明子)。
3、銀杏葉提取行業:國內植物提取行業經過二十多年的積累和發展,從2005年的50多億已經成長為2013年的160多億元,從事植物提取的企業也從2005年的200多家發展到現在的3000多家。2014年1~11月,中藥類產品出口總額達30億美元,其中,植物提取物達16億美元。這次桂林興達藥業有限公司就是業內規模較大的銀杏葉提取物生產企業,且以銀杏葉提取物為主,年生產銀杏葉提取物高達50噸。
為何造假?如何違法?質量標準的漏洞或許給造假有了可乘之機
銀杏葉提取物主要的化學成分包括內酯類、黃酮類、銀杏酸類等化合物。內酯類和黃酮類是有效活性成分,銀杏酸類為有毒成分。目前國內有2個標準:銀杏葉提取物標準收載于《中國藥典》2010版一部,2013年商務部中國醫藥保健品進出口商會正式對外發布的《銀杏葉提取物國際商務標準》(以下簡稱《國際商務標準》)。前者是強制性標準,在國內生產和銷售必須遵守,后者是行業推薦性標準,大多數銀杏葉提取物出口企業多采用這個標準或者遵照需求方的標準定制。那么問題就來了,桂林興達藥業是如何成功通過層層檢驗關,順利賣給藥企的呢?
1、工藝違規但卻檢測合格:下圖是桂林興達藥業的出廠檢驗報告,由此可見其銀杏葉提取物是合格的,符合《中國藥典》2010版標準。
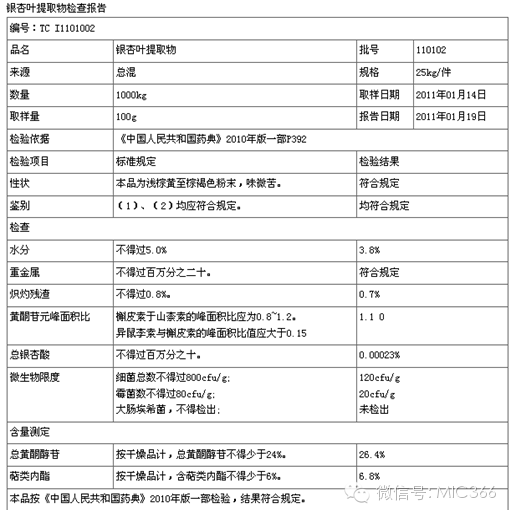
2、擅自變更工藝危害大:那么桂林興達為何要用3%鹽酸違規提取工藝代替法定稀乙醇標準工藝制備銀杏葉提取物?①成本更低:用3%鹽酸提取,每噸能夠節約4000元成本。無水乙醇一噸售價6000~8000元不等,常用的鹽酸一噸售價300~600元不等。鹽酸成本大概只有乙醇的六分之一,乙醇在提取過程中可循環使用,亦可最后回收,但鹽酸的超低價格,后處理方便,環保壓力小更具誘惑。②縮短基礎工藝流程時間:使用鹽酸提取更提高效率。用稀乙醇生產一噸銀杏葉提取物,需要約一周時間,一年也就幾噸的產量。改用鹽酸提取,可以縮短基礎工藝流程時間,桂林興達藥業借此特殊工藝年生產銀杏葉提取物50噸,是其他企業的10倍產能。③還能提高出率:鹽酸提取出率更高,提取出來的東西比較多。銀杏葉中的黃酮類物質,提取過程中溫度稍微高一點,就非常容易流失,對提取環境的要求非常嚴格。如果用鹽酸的話,提取過程中對流程要求相對寬松,很容易把黃酮類物質提取出來,出率更高。雖然能提高黃酮類的含量,但是由于鹽酸能分解萜類內酯,如銀杏內酯(A、B、C、J、K、M)和白果內酯,可能會降萜類內酯對低腦血管疾病的療效。
但是對患者而言風險并不可控:國家食藥監總局通報稱,擅自改變提取工藝,存在“分解藥品有效成分,影響藥品療效”風險。“不按藥典規定的方法提取,是無法保證藥品的藥效和安全性的,當然這并不是說一定會對人體健康造成危害。不按藥典規定的提取方法本身就不合法,只能偷偷來,也就不存在任何對照實驗了,沒有任何實驗報告和文獻可供參考,不可能知道它有什么危害。”國家衛生部全國合理用藥監測系統專家孫忠實認為。
3、《中國藥典》2010版質量標準過低,或許是不法分子鋌而走險的原因
標準之爭:2010年藥典與國際商務標準的比較
①總黃酮醇苷和萜類內酯:兩者沒區別。
②銀杏酸后者要求更高:國內外大量文獻報道顯示,銀杏酸具有細胞毒性、胚胎毒性、致敏性及致突變作用,被廣泛認為是銀杏葉提取物及其制劑中的毒性物質,WHO及多國藥典(包括現行版EP和USP)要求銀杏提取物中總銀杏酸的含量不得大于5mg/kg,現行《中國藥典》2010年版要求銀杏葉提取物中銀杏酸限度小于10mg/kg,顯然已經落后于國際標準。國外的銀杏葉制劑對銀杏酸含量有指標控制,德國最高衛生主管機構(BGA)的公定書中明確要求金納多注射劑銀杏葉酸<5mg/kg(5ppm),該產品實際控制在1個ppm。到了2012年,國家藥監局新修訂舒血寧注射液國家藥品標準中銀杏葉酸的限量才與國際接軌。
③其他相關物質(蘆丁、槲皮素、山奈酚、異槲皮素)后者監測更多:《中國藥典》2010版并未明確規定,而《國際商務標準》有明確規定。如果是非正常生產,這三項指標會有變化。反過來查有沒有出現一些不應該出現的殘留物也是個較好選擇。
《中國藥典》2010版與《國際商務標準》比較表
|
成分含量
|
2010年藥典標準
|
國際商務標準
|
|
總黃酮醇苷
|
≥24%
|
≥24%
|
|
萜類內酯
|
≥6%
|
≥6%
|
|
黃酮苷元峰面積比
|
槲皮素于山柰酚的峰面積比應為0.8~1.2;
異鼠李素與槲皮素的峰面積比值應大于0.15
|
槲皮素于山柰素的峰面積比應≥0.7;
異鼠李素與槲皮素的峰面積比值應≥0.1
|
|
總銀杏酸
|
≤10mg/kg
|
≤5mg/kg
|
|
蘆丁
|
/
|
≤0.4 mg/kg
|
|
槲皮素
|
從2015年6月4日起,
對銀杏葉提取物、銀杏葉片、銀杏葉膠囊補充檢測
|
≤0.5 mg/kg
|
|
山奈酚
|
≤0.5 mg/kg
|
|
異槲皮素
|
≤0.2 mg/kg
|
根據造假手段,制定更嚴格的生產規范和檢驗標準,增加和完善檢測指標是一個較好的辦法。因此,從銀杏葉提取物事件得到的最大教訓就是一定要從源頭---質量標準上堵漏洞,從日常監管---生產規范上下功夫,才能不讓劣藥假藥透過層層監管堂而皇之的披上合法的外衣,成為行業的害群之馬。
銀杏葉提取物市場表現如何?
銀杏葉制劑為全球銷量領先的植物藥品種。銀杏葉提取物是主要作用于腦部、周邊等血液循環障礙的藥物。是老年患者相關癥狀預防用藥和發病后輔助支持用藥。關鍵在于藥物安全性高、副作用小,對失智癥、血管性癡呆、老年性癡呆有較好療效。自1965年德國威瑪舒培博士公司研制出銀杏葉提取物金納多以來,該品種在世界范圍內得到了廣泛應用。隨著全球老年齡化社會的到來,預計該品銷售量將呈現出逐年遞增的態勢。
世界上的銀杏葉制品達300多種,2010年銷售額達70多億美元。位列美國10大最暢銷的天然藥物,在美國的銷售額達20多億美元。歐洲作為藥品銷售額高達20多億歐元(尚不包括保健品)。日本市場有500多種含有銀杏葉的保健食品,銷售額達500多億日元。韓國市場也有6億多美元的銷售額。我國作為資源大國,銀杏樹保有量占全球的80%,出口到國外的銀杏葉提取物卻在逐年萎縮,銀杏葉制劑的國內銷售額也僅有6億多美元。
經過近20年的發展,在我國醫院處方藥和零售藥市場中,銀杏葉提取物制劑是中成藥領域中十分搶眼的品種,是載入《2009年國家醫保目錄》、《國家基本藥物目錄》(2012年版)》銀杏葉膠囊(片、滴丸)、《低價藥目錄》(銀杏葉片、膠囊)的藥物,占盡了天時地利,市場表現也很給力。
數據顯示:2013年,國內醫院腦血管及抗癡呆藥物市場已達到225億元,同比上一年增長率為15%。其中銀杏葉制劑市場占據了20%。國內銀杏葉制劑市場約為45億元。在我國醫院市場中,銀杏葉制劑在心血管疾病和神經內科多種疾病的聯合用藥中占據重要地位,以舒血寧注射液、銀杏達莫注射液為主的國產銀杏提取物制劑已主導了市場。樣本醫院銀杏葉提取物制劑洋品牌逐年下降,形成了國產藥不斷增長的發展態勢。銀杏葉提取物制劑廠商中前五位企業分別是黑龍江珍寶島制藥、神威藥業、威瑪舒培博士藥廠(德國)、華潤雙鶴高科、山西省三九萬榮藥業,市場占比分別為17%、17%、14%、13%和10%,而樣本醫院銷售額領先多屬于注射劑。2013年樣本醫院銀杏葉提取物制劑用藥金額為16億元,同比上一年增長3%,其中注射劑占據了90%的市場,口服制劑占據了10%;其中銀杏葉口服制劑用藥金額為1億元,同比增長了14%,考慮到銀杏葉口服制劑在中醫院和基層醫院使用較多的因素,統計數據顯示較低,另一方面,國產藥用量增長和價格的調整,相對前幾年用藥金額增速有所放緩。預測國內銀杏葉口服制劑銷售額已達到了10億元市場規模。
此外銀杏葉提取物市場已超過了10億元市場規模。
市場呼喚銀杏葉制劑升級換代
前幾年,進口銀杏葉制劑在技術門檻和知識產權保護下,曾占據了國內銀杏葉制劑市場主要份額,尤其是在注射劑方面,以單組份活性成分提取物的高端技術與質量控制優勢下,銷售額曾一路領先。
隨著國內科研力度的加大,逐漸打破了進口藥獨霸市場的局面。其最主要的成份為黃酮醇苷和銀杏內酯,已明確銀杏葉內酯類化合物有:銀杏內酯A、銀杏內酯B、銀杏內酯C、銀杏內酯J、銀杏內酯K、銀杏內酯M以及白果內酯多種物質。前者可清除氧自由基,后者可選擇性拮抗血小板活化因子(PAF)的有害作用。該類產品對動脈血管有擴張作用,適用于心、腦、外周末稍的血液循環障礙和神經障礙所致的臨床病變。
近半個世紀以來,對銀杏葉提取物的研制開發,已從被視為第一代產品的有效成分的總提取物濃縮制劑,發展到了對黃酮醇苷、內酯和銀杏酸含量設定標準的第四代產品。
第一代(低含量、低吸收):銀杏葉片、分散片、膠囊、軟膠囊、顆粒、口服液等口服制劑:銀杏黃酮含量24%以上,銀杏內酯含量6%以上;銀杏酸控制在10mg/kg。
第二代(低含量、高吸收):銀杏達莫注射液、舒血寧注射液、銀杏葉提取物注射液針劑產品:銀杏黃酮含量24%以上,銀杏內酯含量6%以上;銀杏酸控制在10 mg/kg。
第三代(高含量、低吸收):銀杏酮酯片、分散片、顆粒、滴丸、膠囊,高含量黃酮類產品:銀杏黃酮含量44%以上,銀杏內酯含量6%以上;銀杏酸控制在2 mg/kg。
以上三代產品主要成分以銀杏黃酮為主,銀杏內酯的含量始終并未突破6%,對心血管的作用優于腦血管,在心腦共治的同時更側重于心血管系統。
第四代(高含量、高吸收):第四代產品去除了銀杏黃酮,僅保留銀杏內酯,技術含量更高,更容易透過血腦屏障,對腦血管的作用更佳。如銀杏內酯注射液:銀杏內酯(白果內酯、銀杏內酯A、B、C、J)含量99%,銀杏酸不大于1 mg/kg;銀杏二萜內酯葡胺注射液則側重銀杏內酯A、B、C、J、K。
這次涉案的正是第一代、第二代產品,而第三代、第四代產品憑借規范的原料提取物原料備案(上海杏靈科技銀杏酮酯和連云港康緣藥業銀杏二萜內酯)與更高的質量標準幸免于難,并借機發力。醫療機構紛紛下架涉案企業的銀杏葉制劑,而更多的醫療機構擔心惹火上身,索性將所有銀杏葉一代和二代制劑全部做退貨處理,第三代銀杏酮酯類產品,第四代銀杏內酯注射液和銀杏二萜內酯葡胺注射液趁機攻城略地。展望未來,第三代和第四代產品趁著銀杏葉提取物事件的東風,憑借規范的提取工藝、更高的含量和更優秀的療效,必將引領銀杏葉制劑的潮流!
風波過后,植物提取行業將面臨一次整體大整頓。中藥提取物單獨備案和GMP認證將抬高提取物行業的門檻,有合法備案的產品和企業必將大紅大紫,提取物行業也將趨于集中化,成為推動中成藥升級換代的原動力!
本文開頭的王總最近表示:代理中成藥還是要找大牌企業和升級換代新產品,要不然風險太高,賣著賣著缺貨、斷貨煩惱不斷,即使企業重新認證后恢復合法生產,底價暴漲也是必然,可能還會被列入誠信記錄的黑名單和面臨高額罰款,后患無窮。
信息來源:賽柏藍
|