【關注】《中國藥典》不再收載43種藥品
日期:2015/7/25
國家藥監總局近日發布關于實施《中華人民共和國藥典》2015年版有關事宜的公告(2015年第105號) ,公布了《中國藥典》2015年版增修訂品種目錄和不再收載品種目錄。
以下為《中國藥典》2015年版不再收載品種目錄:

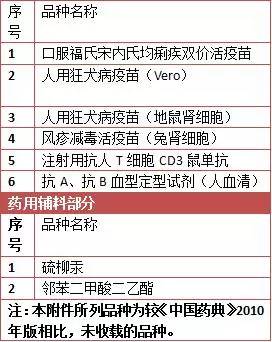
此外,公告指出,《中國藥典》2015年版已由總局2015年第67號公告發布,自2015年12月1日起實施。
一、《中國藥典》是藥品研制、生產(進口)、經營、使用和監督管理等相關單位均應遵循的法定技術標準。
二、《中國藥典》2015年版包括凡例、正文及通則,實施之日起,所有生產上市的藥品標準(包括藥品注冊標準)應當執行本版藥典的相關通用要求。
三、凡《中國藥典》2015年版收載的品種,自實施之日起,原收載于歷版藥典、局(部)頒的同品種國家藥品標準同時廢止。
凡《中國藥典》2015年版品種項下未收載的制劑規格,其質量標準按本版《中國藥典》同品種相關要求執行,規格項按原批準證明文件執行。
凡《中國藥典》2015年版不再收載的歷版藥典曾收載品種(因安全性、有效性等問題撤市的除外),新標準未頒布前,仍執行原藥典標準,但應符合新版藥典的通用要求。
四、藥品注冊標準中收載檢驗項目多于(包括異于)藥典規定或質量指標嚴于藥典要求的,應在執行藥典要求的基礎上,同時執行原注冊標準的相應項目和指標。因輔料及生產工藝等差異導致的檢測項目差異,生產企業應基于科學、質量可控的原則開展研究,必要時申報藥品補充申請。
藥品注冊標準收載檢驗項目少于藥典規定或質量指標低于藥典要求的,應執行藥典規定。
五、《中國藥典》2015年版發布之日(含當日)前已獲批的藥品應自2015年12月1日起執行新版藥典相應要求。如涉及藥品處方、原輔材料和生產工藝等變更的,應按照《藥品注冊管理辦法》規定,在2015年12月1日前向國家食品藥品監督管理總局提交補充申請,審評審批期間仍可執行原標準,審批通過者執行新標準,審批不通過者應立即停產。
僅涉及明確檢測項目、指標限度調整但不涉及藥品處方、原輔材料來源、生產和工藝變更的,應在實施之日前向省級食品藥品監督管理部門(進口藥品報國家食品藥品監督管理總局)備案。
六、《中國藥典》2015年版發布之日起(不含當日)新提交的藥品注冊申請,應按照新版藥典相關要求開展研究并提交申報資料,技術審評部門應按照新版藥典相關要求開展審評,不符合要求者不予批準。
《中國藥典》2015年版發布之日(含當日)前已受理、技術審評部門尚未完成相關技術審評的注冊申請,按照新版藥典的相關要求開展審評;技術審評部門已完成相關技術審評的注冊申請,藥品批準上市后6個月內應符合新版藥典的相關要求。
七、根據《中國藥典》2015年版的增修訂內容,藥品生產企業應在上述規定期限前按《藥品注冊管理辦法》規定及時提出變更藥品說明書和標簽的補充申請。規定期限后生產的藥品必須使用變更后的說明書和標簽。對于通用名稱已作修訂的藥品,其原名稱可作為曾用名過渡使用。
八、藥品生產(進口)企業應積極做好執行《中國藥典》2015年版有關準備工作,對在新版藥典執行過程中發現的問題及時報所在地省級食品藥品監督管理部門,同時應持續完善質量控制和質量標準研究,不斷提高藥品質量控制水平。
九、各省級食品藥品監督管理部門應配合做好《中國藥典》2015年版的宣傳貫徹和加強新版藥典執行中的監督與指導,及時收集和反饋相關問題和意見。
十、國家藥典委員會負責統一組織和協調《中國藥典》2015年版的宣傳貫徹和培訓以及新版藥典執行中的具體技術指導。在其網站專門開辟“中國藥典執行專欄”,及時答復各地反映的有關問題,并適時組織對新版藥典執行情況的專項評估和檢查。
信息來源:醫藥手機報
|