「722慘案」:821家藥企面臨割肉抉擇!
日期:2015/7/25
撤還是不撤?對于很多藥企來說,這是他們目前最為緊迫的問題。
7月22日,國家食藥監總局(CFDA)的《國家食品藥品監督管理總局關于開展藥物臨床試驗數據自查核查工作的公告(2015年第117號)》(簡稱自查公告),這份自查公告被稱“史上最嚴的數據核查要求”。有人戲稱,這是醫藥界的“七二二慘案”。很多藥企緊急開會研討。
國家局在公告中表示,申請人自查發現臨床試驗數據存在不真實、不完整等問題的,可以在2015年8月25日前向國家食品藥品監督管理總局提出撤回注冊申請。今天是7月24日的,距離最后時限只有1個月多一點,估計不少藥企要度過多個不眠之夜。
撤還是不撤呢?建議:還是撤了吧。
國家局在公告中表示,申請人自查發現臨床試驗數據存在不真實、不完整等問題的,可以在2015年8月25日前向國家食品藥品監督管理總局提出撤回注冊申請。
那么撤還是不撤呢?對于申報藥企來說,這可是重大損失。畢竟,已經投入那么多的,國家又提高了注冊成本和要求,再申報的難度加大了不止一點點。心有不甘的是肯定的。
但是,我們還是建議您,如果真的不符合國家規定,還是撤了吧。
不撤回的話,一旦被查出問題,國家局在公告中,指出了后果:
對核查中發現臨床試驗數據真實性存在問題的相關申請人,3年內不受理其申請。藥物臨床試驗機構存在弄虛作假的,吊銷藥物臨床試驗機構的資格;對臨床試驗中存在違規行為的人員通報相關部門依法查處。將弄虛作假的申請人、臨床試驗機構、合同研究組織以及相關責任人員等列入黑名單。
也就說藥企面臨的將是三年內不得再申請的處罰,這個處罰不可謂不嚴厲,同時,藥物臨床試驗機構,人員等面臨嚴懲,這些機構必然也會向藥企施壓。逼迫他們做出對于自己有利的做法,如果因為數據作假導致這些機構喪失臨床試驗資格,對他們的損失可謂重大。內外力聯合施壓下,藥企可能很難撐得住。
在看看國家局的表態,四個最嚴,最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責。看看國家飛檢的檢查,看看銀杏葉事件中,國家局的雷霆手段,我們猜想,對于藥品注冊材料作假的,想來治理手段不會手軟。
讓我們看看國家藥審面臨的任務:今年兩會期間,國家食藥監總局(CFDA)藥品注冊司官員在醫藥界兩會代表座談會上指出,爭取用三年時間解決藥品審評時限過長的問題。
國家局的表態出來之后,業界普遍反應是不可能,但是看看國家局的動作,先是提高了注冊成本,讓以后藥品注冊費用大幅度漲上來,然后現在是清理存貨。
據官方公布清單顯示,1622個受理號中,不少是2008年以前的受理號。以目前對臨床數據的高要求去自查2008年以前申報的臨床項目,基本沒有多少項目能符合要求現有的標準。估計大部分品種要被提出注冊排隊了。
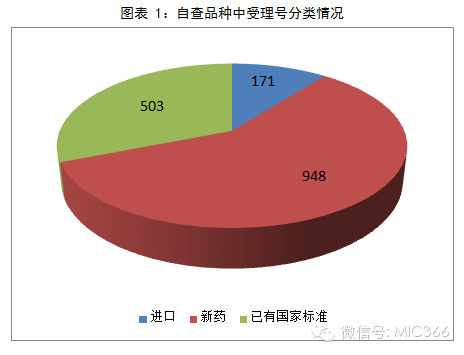
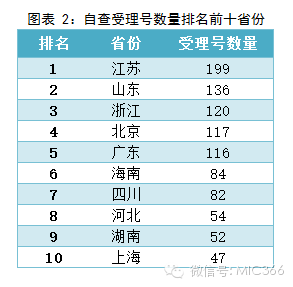
在自查的品種中,江蘇排名第一,199個受理號需要自查;其次是山東136個受理號;浙江排名第三,共120個受理號。
產品通用名方面,共968個通用名涉及本次自查,其中苯磺酸氨氯地平片需自查的受理號數最多,共19個;位列第二的是瑞舒伐他汀鈣片,有17個自查受理號;奧硝唑片以14個受理號排第三。
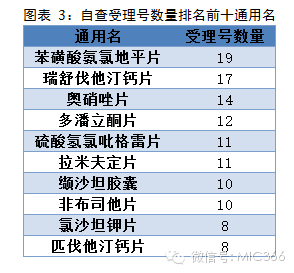
達沙替尼片、人免疫球蛋白、法羅培南鈉片、奧硝唑片、鹽酸帕洛諾司瓊注射液、苯磺酸氨氯地平片和注射用頭孢替坦二鈉是國內上市公司主要需要自查的產品,每個通用名中各有4個受理號涉及自查。
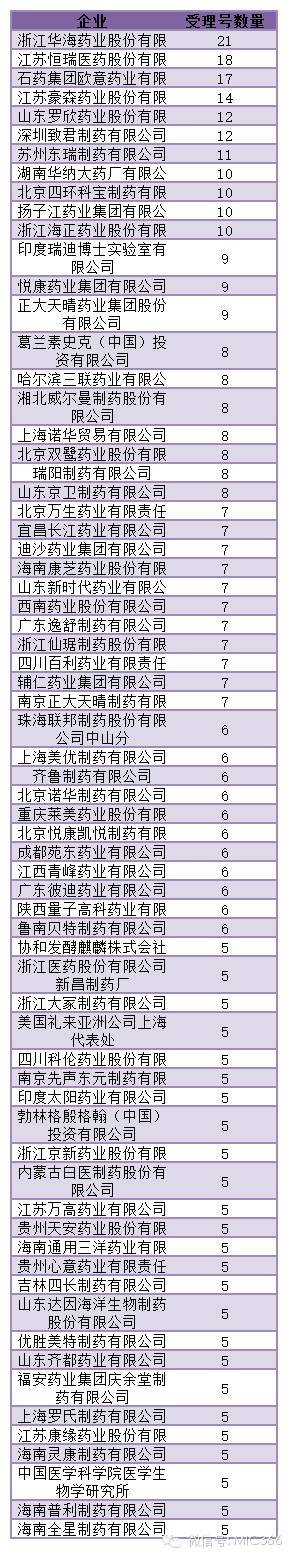
本次自查名單涉及企業共821家,以下為自查品種超過5個的藥企匯總,其中華海藥業需要自查的受理號最多,達到21個。
圖表4:自查品種超過5個藥企排名
此外,賽柏藍提醒藥企注意的是,這1622個品種只是第一步,根據國家局的公告,國家局的公告在第一條就表示:自本公告發布之日起,所有已申報并在總局待審的藥品注冊申請人,均須按照《藥物臨床試驗質量管理規范》等相關要求,對照臨床試驗方案,對已申報生產或進口的待審藥品注冊申請藥物臨床試驗情況開展自查,確保臨床試驗數據真實、可靠,相關證據保存完整。
也就說所有注冊藥品必須進行自查,而如果沒有自查報告的話,CFDA是可以不予注冊的。
信息來源:賽柏藍
|