第一部分:2015年上半年CFDA飛行檢查報告信息匯總分析
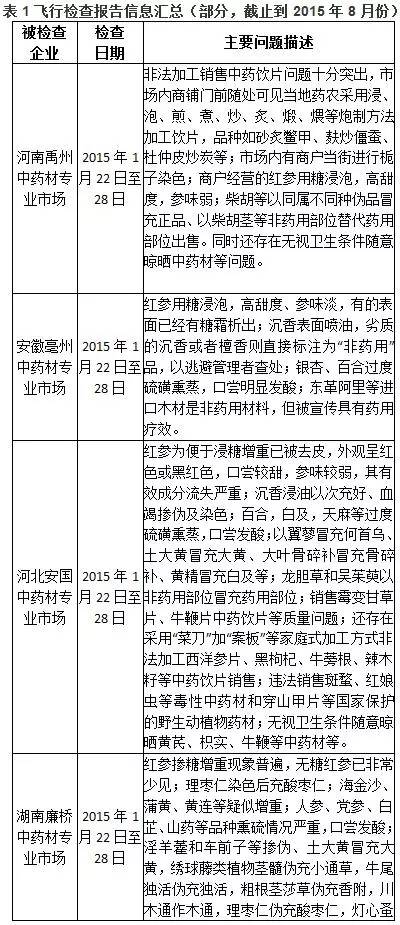
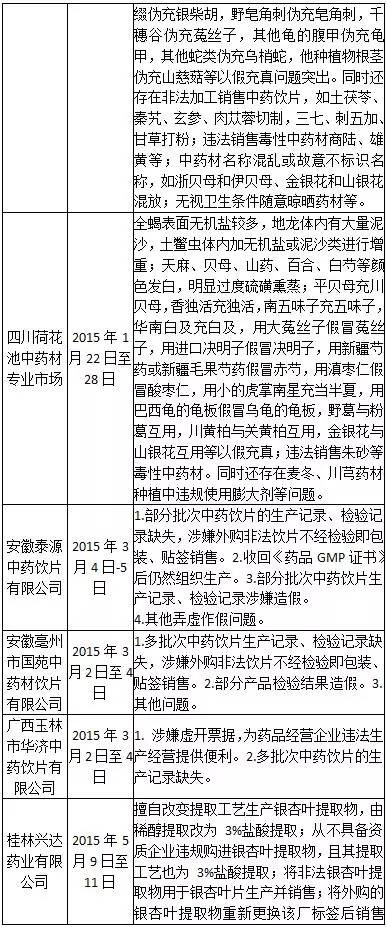
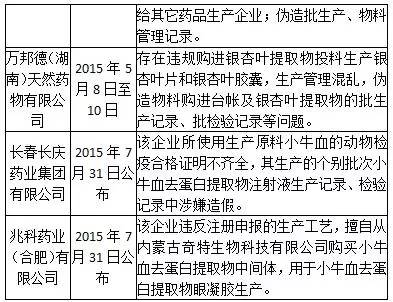
到2015年8月份為止,CFDA審核查驗中心組織對國內制藥企業開展了多輪飛行檢查。根據目前披露的情況來看,國內多家制藥企業管理混亂,嚴重違反GMP規范,弄虛作假,問題是很嚴重的。下表匯聚了截止到2015年8月份的飛行檢查報告信息。因為部分企業問題類似,因此下表沒有包括所有被飛行檢查的企業。
第二部分:2015年初法規透漏出來的信息
據中國醫藥報報道,在2014年底,國家總局食品藥品審核查驗中心(簡稱核查中心)主任楊威在談到2015年工作思路時,提到今后將堅持以問題為導向,運用檢查、檢驗、監測綜合手段發揮飛行檢查的威懾作用,重點圍繞高風險企業或品種開展檢查。多組分生化藥提取、前處理等過程,中成藥、化藥制劑共線生產環節的交叉污染問題;疫苗、血液制品等高風險品種等是檢查重點。
第三部分:2015年中期CFDA法規解讀
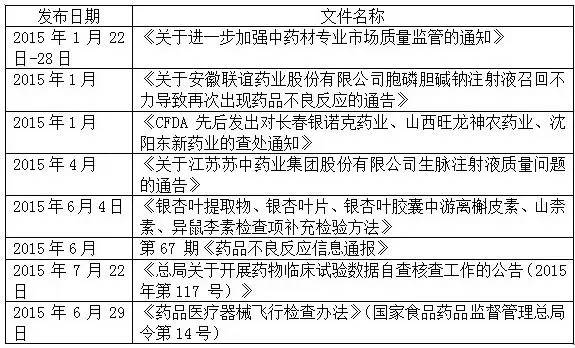
在2015年7月份,CFDA連續頒布多部重要法規和通知,預示著下一步CFDA的檢查重點和監管方向。具體情況參見下表。
第四部分:CFDA檢查組將向哪里飛?
根據上面的法規解析和信息匯總,我們可以預測,在2015年下半年,CFDA的檢查組會將監管重點指向如下方向:
第一、中藥飲片企業、中藥提取物車間將會繼續成為飛行檢查重點。
第二、高風險企業,例如中藥注射劑、疫苗、血液制品和其他無菌產品企業會繼續作為飛行檢查的重點對象。
第三、生化類藥品生產企業,會繼續作為重點監管對象而被飛行檢查。
第四、因為市場調查,顯示價格倒掛的企業,將會被作為飛行檢查重點企業。
第五、高風險醫療器械企業,將會成為飛行檢查新重點。
第六、臨床試驗質量的檢查,將會成為未來一段時間的飛行檢查重點。
第七、中藥和化學共線車間的規范管理,將會是飛行檢查中的重點對象。
第八、行業對手的舉報和互相打壓,將會成為飛行檢查的另外一部分信息來源。
信息來源:上海醫藥商業行業協會