湖北飛檢,20張證照被收回/撤銷
日期:2015/9/17
昨日(9月15日),湖北省藥監局發布了《關于嚴格執行新修訂藥品GMP、GSP加強藥品監督檢查的通知》。
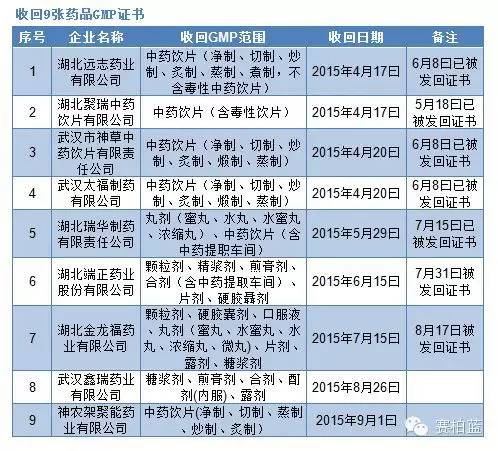
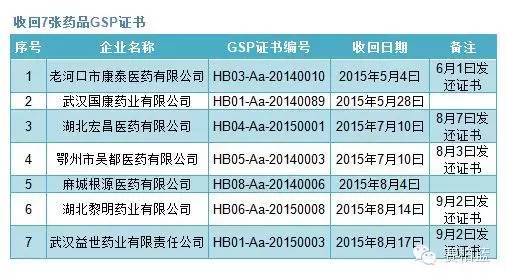
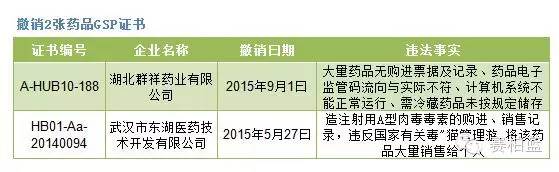
根據《通知》內容,湖北省藥監局今年以來先后對42家藥品生產經營企業開展飛行檢查,發現藥品生產經營企業存在不同程度違反藥品GMP及藥品GSP的行為,共依法收回了11張藥品GMP證書(只列出9張)、7張藥品GSP證書,撤銷了2張藥品GSP證書。不過,從后面備注可以看出,收回GMP或者GSP證書后,經過整改,這些企業的證書又被發回。
賽柏藍根據湖北藥監局公告,整理出上述《通知》中提及所涉及的收回或撤銷的證書,具體情況如下:
同時,《通知》羅列出飛檢中存在的問題,以及對飛檢工作的要求:
一、藥品飛行檢查發現的主要問題
1、藥品生產環節:
主要存在未按批準的生產工藝組織生產、生產管理混亂、生產檢驗記錄造假,中藥生產企業以次充好、以非藥用部位冒充藥用部位投料,飲片生產企業直接外購飲片分裝、為他人非法制售中藥飲片提供便利等違法違規問題。
2、藥品經營環節:
主要存在質量負責人或質量管理部門負責人“掛靠”兼職、在經核定的倉庫外設立庫房、藥品儲存溫度不符合規定、溫濕度自動監測系統作假、計算機管理混亂、飲片經營企業與生產企業相互勾結、擅自加工分裝、藥品電子監管碼流向與實際不一致等問題。
二、強化藥品生產經營企業質量安全主體責任
藥品飛行檢查發現的問題暴露出我省部分企業存在藥品GMP、GSP認證檢查與企業實際生產經營“兩張皮”,在執行新修訂藥品GMP、GSP方面流于形式,不能持續合規地遵守藥品生產經營質量管理規范的要求,少數企業甚至明知故犯、知法犯法、有意作假,觸及了藥品質量安全底線。
因此,各地要組織轄區內藥品生產經營企業針對以上問題開展自查自糾,迅速控制藥品安全風險,盡快糾正違反藥品GMP、GSP的行為,主動采取措施減少或消除由此帶來的安全隱患,切實增強藥品生產經營質量安全主體責任意識。
三、加強藥品生產經營企業監督檢查
藥品飛行檢查發現的問題同時暴露出我們監管中存在著藥品GMP、GSP認證把關不嚴、跟蹤檢查和日常監督檢查不到位、對企業長期存在的違法生產經營未能及時發現等問題。因此,各地要對照上述問題,舉一反三,認真分析,深刻反思,認真落實屬地監管責任,切實加強藥品監督檢查,杜絕此類問題再次發生。
各地要按照新修訂藥品GMP、GSP的要求,充分運用投訴舉報、電子監管、藥品抽驗、風險監測、不良反應報告等信息,采取“四不兩直”的方式,對通過認證的企業有針對性進行突擊檢查。
1、對發現不符合藥品GMP、GSP的,一律責令停業整頓;
2、對有欺騙造假等嚴重違法違規行為的,必須收回或撤銷藥品GMP、GSP證書,依法立案查處;對存在質量安全問題的藥品,要堅決監督召回銷毀;
3、對藥品生產經營屢犯不改的,從重從嚴予以處理;
4、涉嫌犯罪的,一律移送公安機關處理。
各地要盡快明確負責藥品生產經營日常監管的責任人,并在企業“上墻”公開,檢查結果及時向社會公告,接受社會監督。省局將持續加大藥品飛行檢查力度,對監管轄區問題突出、執法不嚴、失職瀆職的,將采取“一案雙查”、“一事雙談”、“一函雙發”的形式,依法依紀追究相關監管人員的責任。
信息來源:賽柏藍
|