銀杏葉藥品抽驗結果公布:4家藥品生產企業不合格
日期:2015/10/20

10月15日,CFDA在官方網站上發布了關于公布銀杏葉軟膠囊等銀杏葉藥品抽驗結果的通告(2015年第73號)。通告顯示,受CFDA委托,中國食品藥品檢定研究院對從市場上抽取的銀杏葉軟膠囊、銀杏葉滴丸等劑型,按照《關于發布銀杏葉軟膠囊等藥品補充檢驗方法的公告》(國家食品藥品監督管理總局公告2015年第142號)進行檢驗。抽驗結果如下:
包括:
●銀杏葉軟膠囊38批
●銀杏葉滴丸24批
●舒血寧注射液62批
●銀杏葉提取物注射液7批
●銀杏達莫注射液36批
●銀杏葉滴劑1批
其中,檢出
●不合格銀杏葉軟膠囊16批
●不合格銀杏葉滴丸13批
4個品種未檢出不合格產品
●舒血寧注射液
●銀杏葉提取物注射液
●銀杏達莫注射液
●銀杏葉滴劑

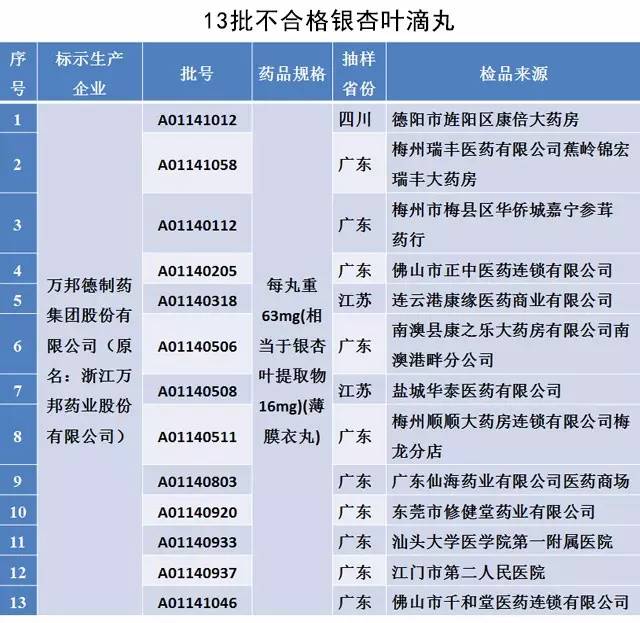
●遼寧盛生醫藥集團有限公司制藥分公司
●遼寧仙草堂藥業股份有限公司
●洛陽君山制藥有限公司
其中,遼寧盛生醫藥集團有限公司制藥分公司、遼寧仙草堂藥業股份有限公司在自檢階段已主動召回產品。通告要求洛陽君山制藥有限公司、萬邦德制藥集團股份有限公司在2015年10月20日前,完成已上市銷售的全部產品的召回工作。
第三階段銀杏葉藥品中槐角苷專項監督抽驗結果公布
同日,CFDA官方網站上也發布了關于公布第三階段銀杏葉藥品中槐角苷專項監督抽驗結果的通告(2015年第72號)。以下為通告詳情:
2015年9月6日到9月16日,食品藥品監管總局組織北京、河北、遼寧、吉林、江蘇、浙江、廣東、廣西、重慶、四川、陜西、甘肅等12省(區、市)食品藥品監管部門開展第三階段銀杏葉藥品專項監督抽驗,對第一、第二階段監督抽驗中檢出的不合格藥品按食品藥品監管總局發布的《銀杏葉提取物、銀杏葉片及銀杏葉膠囊中槐角苷檢查項補充檢驗方法》進行了檢驗,現將抽驗結果通告如下:
一、在第一、第二階段檢出不合格的185批銀杏葉藥品中,共有125批藥品檢出槐角苷,涉及27家企業,分別是:天津亞寶藥業科技有限公司、河北天成藥業股份有限公司、唐山市福樂藥業有限公司、山西仟源醫藥集團股份有限公司、吉林省跨海生化藥業制造有限公司、吉林省正和藥業集團股份有限公司、黑龍江天宏藥業股份有限公司、江蘇晨牌藥業集團股份有限公司、江蘇飛馬藥業有限公司、江蘇潤邦藥業有限公司、江蘇吳中醫藥集團有限公司蘇州制藥廠、南京易亨制藥有限公司、安徽圣鷹藥業有限公司、蕪湖綠葉制藥有限公司、江西匯仁藥業有限公司、湖北午時藥業股份有限公司、湖南方盛制藥股份有限公司、湖南華納大藥廠有限公司、廣東新峰藥業股份有限公司、廣東一力羅定制藥有限公司、廣西半宙大康制藥有限公司、桂林紅會藥業有限公司、桂林興達藥業有限公司、海口奇力制藥股份有限公司、四川科倫藥業股份有限公司、貴州信邦制藥股份有限公司、貴州益佰制藥股份有限公司。
相關企業已對不合格藥品采取召回措施并公布了召回信息。
二、上述企業涉嫌非法添加或使用非法添加的銀杏葉提取物用于銀杏葉藥品生產,各企業需于10月25日前向所在省食品藥品監管局報告產品不合格的原因及情況:屬于本企業自己非法添加的,需說明2015年1月1日以來非法添加的物質、時間、數量及所生產的產品批次、相關責任人(包括企業法定代表人、企業負責人、質量負責人、生產負責人及其他直接責任人),并附相關發票復印件;屬于從外部采購銀杏葉提取物的,需說明2015年1月1日以來逐批采購的時間、數量、來源、生產產品的批次、相關責任人員(包括企業法定代表人、企業負責人、質量負責人、生產負責人及其他直接責任人),并附相關發票復印件。相關省(區、市)食品藥品監管局需于10月30日前將企業報告情況匯總報食品藥品監管總局。企業屆時不報告的,一律按本企業自己非法添加從重查處。
三、天津、河北、山西、吉林、黑龍江、江蘇、安徽、江西、湖北、湖南、廣東、廣西、海南、四川和貴州省(區、市)食品藥品監管局要對相關企業立案調查,并于11月10日前查清2015年1月1日以來企業非法添加的事實及相關責任人。銀杏葉藥品生產企業違法案件處理的相關政策規定,食品藥品監管總局另行制定。
信息來源:醫藥經濟報
|