【深度盤點】截止目前,CFDA批準上市的國產單抗,僅10種
日期:2015/10/20
1986年,世界上首個單克隆抗體藥物——用于治療器官移植出現的排斥反應的抗cd3單抗OKT3獲得美國FDA的上市批準,由此拉開了單抗藥物發展的序幕。如今,單抗已成為現代生物制藥的重要組成部分,更是制藥企業爭相布局的“金礦產業”。
經過不到三十年的快速發展,單抗藥物在腫瘤、自身免疫病、心血管疾病等領域取得了很好的成績。隨著獲批抗體藥物數量的增加,抗體市場規模也在不斷擴大。1997年全球單抗藥物銷售額僅達3.7億美元,而2007年銷售額增長到了220億美元,2013年這個數字已達到620億。
據了解,目前全國有100多家企業在做單抗,除了中信國健、賽金生物、百泰生物、海正藥業等一些老牌企業外,近幾年還涌現出了很多新興企業,包括麗珠單抗、信達生物、百濟神州、嘉和生物以及布局生物藥領域的恒瑞醫藥等。
以下是部分相關公司近期大事記一覽:
恒瑞醫藥
9月3日,恒瑞醫藥發布公告稱,公司與美國Incyte公司在美國達成協議,將具有自主知識產權的用于腫瘤免疫治療的PD-1單克隆抗體(代號“SHR1210”)項目有償許可給美國Incyte公司。Incyte公司將獲得除中國大陸、香港、澳門和臺灣地區以外的全球獨家臨床開發和市場銷售的權利。
根據協議,Incyte公司將向恒瑞支付首付款2500萬美元,另外還包括不超過9000萬美元的上市里程碑付款、1.5億美元的臨床優效里程碑付款以及不超過5.3億美元的銷售業績里程碑付款。此外,SHR1210在國外上市后,恒瑞按照約定比例從其年銷售額中提成。
信達生物
10月12日,被業內的人比喻成“含著金湯匙”出生的信達生物再創記錄。公司與禮來達成三個腫瘤免疫治療雙特異性抗體藥物的全球開發合作協議,里程碑付款總金額超過10億美元,成為迄今為止中國新藥國際合作項目的所涉金額最大的一樁。
此前,信達與禮來曾經達成新藥合作開發的戰略合作協議,由禮來提供一個品種,信達提供兩個品種,共同開發。首付5600萬美元,其中一個項目的里程碑付款就達4億美元。
而此番新合作協議,主角是三個新型雙特異性腫瘤免疫治療抗體,其中信達生物將合作主導中國市場的開發、生產和銷售,禮來將合作主導國外市場的開發、生產和銷售。據悉,三個抗體均使用來自于信達生物自主研發的PD-1單抗,是目前最有前景的新型雙特異性腫瘤免疫治療抗體。
嘉和生物
10月14日,沃生生物發布公告稱,其控股子公司嘉和生物研發的單抗產品“注射用重組抗HER-2人源化單克隆抗體(曲妥珠單抗類似藥)”和“注射用重組抗TNF-alpha人鼠嵌合單克隆抗體(英夫利昔單抗類似藥)”均已獲得CFDA頒發的臨床批件,現正在開展臨床研究工作。
為加快上述兩個單抗產品的研發及產業化進程,嘉和生物設立了全資子公司玉溪嘉和生物技術有限公司(下稱“玉溪嘉和”),由玉溪嘉和作為實施主體投資建設“治療性單克隆抗體藥物產業化項目”。項目建設工期計劃為2年,總投資為25114.94萬元;計劃建成年產36萬支曲妥珠單抗類似藥和40萬支英夫利昔單抗類似藥的生產線,合計實現年產76萬支單克隆抗體藥物的生產規模。
百濟神州
6月5日,百濟神州(BeiGene)宣布其針對晚期腫瘤治療的BGB-A317臨床一期試驗已經入組了第一位患者。BGB-A317是一個高選擇性的強效的全人源的抗PD-1的單克隆抗體候選藥物。
10月16日,百濟神州向美國證交會(SEC)提交了籌集高達1億美元的首次公開募股(IPO)申請,計劃以BGNE作為股票代碼登陸納斯達克市場。公開資料顯示,百濟神州先后在于去年11月和今年5月完成兩輪融資,價格分別為4.5億人民幣和6億人民幣;如果此次IPO成功,將極大推進百濟神州臨床試驗的進程。
CFDA批準上市的10種國內單抗
目前,我國抗體藥物開發市場正處于高速發展的時期;在過去的3-5年內,國內陸續有創新的抗體藥物上市或者進入后期臨床階段,這些突破性的成果一步步推動著我國抗體產業的發展。然而,國內單抗的市場規模還較小,具有成熟的抗體工業體系和規模化生產能力的企業為數不多。
由于國內單抗等生物藥物的全面研發起步較晚,截至目前年底,CFDA批準上市的國產單克隆抗體藥物數量僅有10種,占國內上市單抗藥物總數不到一半,銷售額僅占全部生物技術藥物的1.7%,遠低于全球34%的水平,市場占有率不高。下表是已獲CFDA批準的國產單克隆抗體:
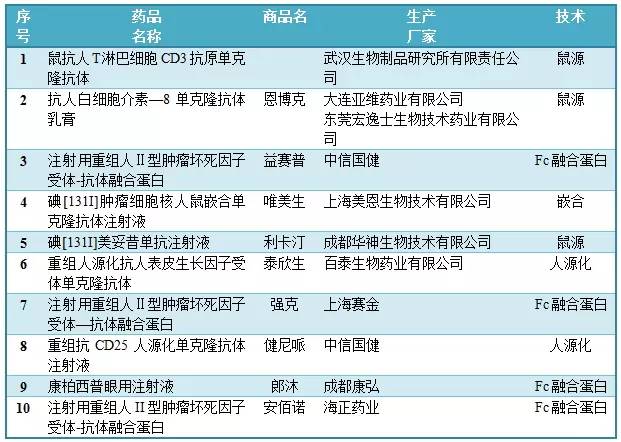
數據來源:沃森生物公司研究報告(2015-10-15)
國內的10個產品中,4個是鼠源型,1個嵌合型和2個人源化單抗,另有4個Fc融合蛋白類藥物,而國外市場上人源和全人源化單抗藥品約占90%。而目前真正實現產業化的抗體藥物只有上海中信國健藥業有限公司的益賽普、健尼哌以及百泰生物藥液有限公司的泰欣生。
目前,外資單抗藥品目前仍是國內市場的主導產品,但因其價格昂貴,國內大多數患者消費不起單抗等生物藥物的治療。近幾年,越來越多的國內企業通過自主研發或者合作開發的方式發展單克隆抗體產品;其中,以上提到的一些企業也取得了非常突出的成果。這些消息對國內的患者來說都是巨大的福音。
1. 注射用抗人T細胞CD3鼠單抗
生產廠家:武漢生物制品研究所有限責任公司
國藥準字S19990012、獲批時間2010-09-30
適應癥:腎臟移植、器官移植病人之急性排斥反應的治療和預防。
藥理作用:鼠源性抗人T淋巴細胞CD3抗原單克隆抗體,具有免疫抑制作用,可逆轉對移植器官的排斥反應,其作用機理可能是阻斷急性同種異體排斥反應中起主要作用的T細胞功能。體外試驗結果表明,該藥可作用于存在人類T細胞膜上并與其抗原識別結構相結合的CD3分子,從而影響該分子傳遞活化信號的功能,導致細胞因子釋放,并因此阻斷效應細胞的增殖和功能;體內試驗結果表明,該藥可與大部分外周血液和組織中的T細胞發生反應,但尚未發現該藥可與其他血液成分或人體其他組織發生反應。
2. 抗人白介素-8鼠單抗乳膏(恩博克)
生產廠家:大連亞維藥業有限公司、東莞宏逸士生物技術藥業有限公司
2003-04-17,CFDA批準了東莞宏逸士生物技術藥業有限公司抗人白細胞介素-8單克隆抗體乳膏(國藥試字S20010004)
2010-08-30,CFDA批準了大連亞維藥業有限公司抗人白介素-8鼠單抗乳膏(國藥準字S20030093)
適應癥:用于尋常型銀屑病、亞急性濕疹的治療
藥理作用:白細胞介素-8對中性粒細胞具有趨化作用。據文獻報道,銀屑病病灶皮膚中的白細胞介素-8濃度高于正常水平,推測其可能是銀屑病病灶早期形成的因素之一。動物試驗結果提示,該藥的作用機理可能是通過中和局部組織中的白細胞介素-8,降低中性粒細胞的聚集,從而減輕皮膚炎癥的反應。單克隆抗體能有效地中和銀屑病皮損組織中過量的白細胞介素-8,從而阻止嗜中性粒細胞對皮膚的浸潤,抑制表皮角質化細胞的異常增生,消除炎癥,達到治療銀屑病的目的。
3.注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白(益賽普)
生產廠家:上海中信國健藥業股份有限公司
國藥準字S20050058(12.5mg/瓶)、國藥準字S20050059(25mg/瓶),獲批時間為2015-01-27
適應癥:1.中度及重度活動性類風濕關節炎;2. 18歲及18歲以上成人中度至重度斑塊狀銀屑病;3.活動性強直性脊柱炎。
藥理作用:已知腫瘤壞死因子(TNF-a)是類風濕性關節炎、銀屑病、強直性脊柱炎等病理過程中的一個主要炎性介質,其參與調控的炎癥反應可導致關節的病理改變。該藥的作用機制為競爭性地與血中TNF-a結合,阻斷它和細胞表面TNF受體結合,降低其活性。
4.碘[131I]腫瘤細胞核人鼠嵌合單克隆抗體注射液(唯美生)
生產廠家:上海美恩生物技術有限公司
國藥準字S20060061,獲批時間為2006-08-31
適應癥:適用于放化療不能控制或復發的晚期肺癌的放射免疫治療
藥理作用:該藥是一種用于實體瘤放射免疫治療的131I標記的人鼠嵌合型單抗,該單抗靶向作用于腫瘤壞死區中變性、壞死細胞的細胞核,將其荷載的放射性131I輸送到實體瘤壞死部位,通過其局部放射性而對實體瘤組織細胞產生殺傷作用。
5. 碘[131I]美妥昔單抗注射液(利卡汀)
生產廠家:成都華神生物技術有限公司
國藥準字S20060064,獲批時間為2011-05-18
適應癥:不能手術切除或術后復發的原發性肝癌,以及不適宜作動脈導管化學栓塞(TACE)或經TACE治療后無效、復發的晚期肝癌患者。
藥理作用:該藥是一種用于導向放射治療肝癌的碘[131I]標記的新型單抗。美妥昔單抗—HAb18 F(ab’)2可與分布在肝癌細胞膜蛋白中的HAb18G抗原結合,將其荷載的放射性碘[131I]輸送到腫瘤部位,從而產生抗腫瘤作用。
6. 尼妥珠單抗注射液(泰欣生)
生產廠家:百泰生物藥業有限公司
國藥準字S20080001,獲批時間為2012-12-25
適應癥:適用于與放療聯合治療表皮生長因子受體 (EGFR) 表達陽性的III/IV期鼻咽癌。
藥理作用:EGFR是一種跨膜糖蛋白,分子量為170KD,其胞內區具有特殊的酪氨酸激酶活性。體內和體外研究顯示,尼妥珠單抗可阻斷EGFR與其配體的結合,并對EGFR過度表達的腫瘤具有抗血管生成、抗細胞增殖和促凋亡作用。
7. 注射用重組人Ⅱ型腫瘤壞死因子受體—抗體融合蛋白(強克)
生產廠家:上海賽金生物醫藥有限公司
國藥準字S20110004,獲批時間為2011-04-11
適應癥:適用于中度及重度強直性脊柱炎患者。
藥理作用:重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白是一個二聚體的融合蛋白,包含人75KDa腫瘤壞死因子受體(TNFR)(p75)的細胞膜外配體結合部分與人IgG1的Fc片段,包含934個氨基酸,表觀分子量約為150K道爾頓(KDa)。
TNF是機體自然產生的一種細胞因子,參與正常的炎癥和免疫反應。在強直性脊柱炎關節病變的炎癥反應中,TNF起著重要的作用。TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)兩類受體,它們均以單體的形式存在于細胞表面。TNF的生物學活性取決于它與細胞表面兩類受體分子的結合。重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白的作用機制是競爭性地與TNF結合,阻止TNF與細胞表面TNF受體的結合,抑制TNF的生物學活性。
8. 重組抗CD25人源化單克隆抗體注射液(健尼哌)
生產廠家:上海中信國健藥業股份有限公司
國藥準字S20110001,獲批時間為2011-01-12
適應癥:適用于預防腎移植后急性排斥反應的發生,可與含鈣調素抑制劑和皮質類固醇激素的免疫抑制方案聯用。
藥理作用:該藥是一種重組人源化抗Tac單克隆抗體,屬于lgG1/k型抗體。作為白細胞介素-2受體拮抗劑,它與IL-2競爭,高特異性結合IL-2受體復合物(在激活的T細胞表面表達,而非靜止的T細胞)的a-亞單位(Tac抗原),從而抑制IL-2生物活性。使用本品可抑制IL-2介導的淋巴細胞激活,亦即抑制了移植排斥反應過程中細胞免疫的關鍵通路。
9. 康柏西普眼用注射液(朗沐)
生產廠家:成都康弘生物科技有限公司
國藥準字S20130012,獲批時間為2013-11-27
適應癥:用于治療濕性年齡相關性黃斑變性(AMD)
藥理作用:該藥是一種VEGF受體與人免疫球蛋白Fc段基因重組的融合蛋白,通過結合血管內皮生長因子VEGF,競爭性抑制VEGF與受體結合并阻止VEGF家族受體的激活,從而抑制內皮細胞增殖和血管新生,達到治療濕性年齡相關性黃斑變性的目的。
10. 注射用重組人II型腫瘤壞死因子受體-抗體融合蛋白(安佰諾)
生產廠家:浙江海正藥業股份有限公司
國藥準字S20150005(12.5mg/瓶)、國藥準字S20150006(25mg/瓶),獲批時間為2015-04-09
適應癥:中度-至重度活動性類風濕關節炎、活動性強直性脊柱炎 和18 歲及 18 歲以上成人中度及重度斑塊狀銀屑病
藥理作用:已知腫瘤壞死因子(TNF-a)是類風濕性關節炎、銀屑病、強直性脊柱炎等病理過程中的一個主要炎性介質,其參與調控的炎癥反應可導致關節的病理改變。該藥是一種通過中和腫瘤壞死因子體內生物學活性而發揮治療作用的生物制劑。
特別備注:
1. 東莞宏逸士生物技術藥業有限公司抗人白細胞介素-8單克隆抗體乳膏(國藥試字S20010004)、上海美恩生物技術有限公司碘[131I]腫瘤細胞核人鼠嵌合單克隆抗體注射液(國藥準字S20060061),信息來自網絡,未在CFDA官網查到。
2. 本文表格以及部分信息參考自沃森生物公司研究報告:《沃森生物:玉溪嘉和生物技術有限公司治療性單抗藥物產業化項目可行性研究報告》
信息來源:新康界
|