藥品安全監管形勢分析與發展趨勢
日期:2015/10/28
藥品安全直接關系著人民群眾的身體健康和生命安全,確保藥品安全就是最大的民生。近幾年,CFDA陸續公布了一批政策以及組織開展了一系列行動,旨在加強藥品安全的監督與管理。飛行檢查、不良反應監測、電子監管碼……哪些對您的企業影響最大呢?
“四個最”的藥品飛行檢查
2015上半年,“藥品飛行檢查”、“銀杏葉提取物”等關鍵詞掀起了一股熱浪,多家上市藥企被卷入,相關新聞連續多天搶占了業內媒體的頭條,藥品飛行檢查著實令不少企業聞風色變。
據米內網記者統計的信息,食品藥品監管部門(含各地食品藥品監督管理局)在2015年前10個月共對44家企業進行了飛行檢查,檢查重點在中藥材市場、中藥飲片生產企業、藥品生產企業以及藥品批發企業,期間有一批企業受到了重大處罰。
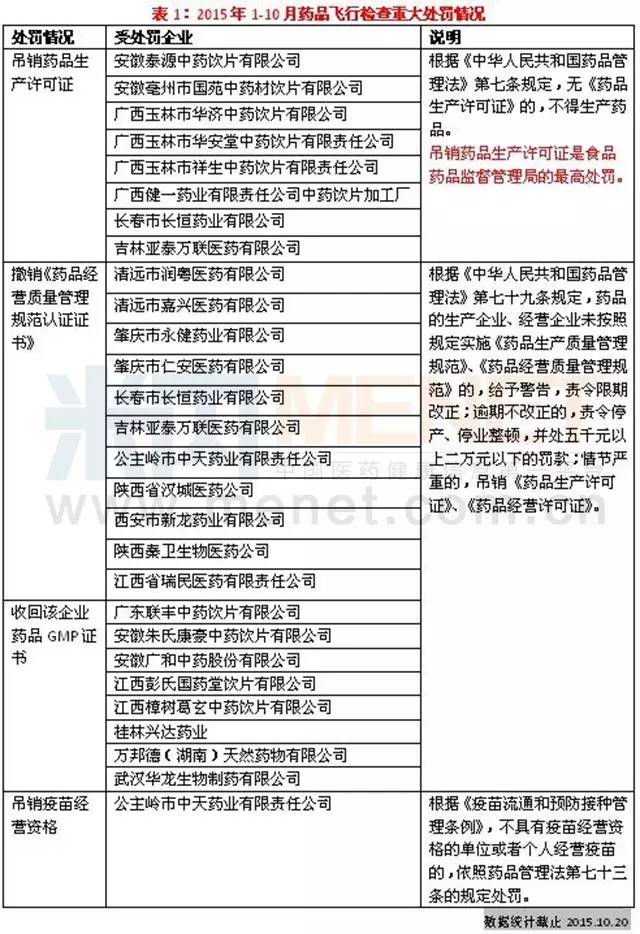
CFDA在今年6月出臺了《藥品醫療器械飛行檢查辦法》,自2015年9月1日起施行。《辦法》將藥品和醫療器械研制、生產、經營和使用全過程納入飛行檢查的范圍,詳細規定了啟動、檢查、處理等相關工作程序。“最嚴的標準、最嚴的監管、最嚴的處罰、最嚴的問責”已經成為飛行檢查最基本的尺度,對于企業而言既是一種壓力,也是一種動力,只有合規經營把好質量關,才能把企業做大做強。
持續發熱的藥品不良反應監測
我國早在1998年就正式加入了世界衛生組織國際藥品監測合作中心,2004年國家發布《藥品不良反應報告和監測管理辦法》,明確實行藥品不良反應報告和監測制度,這些年來這項工作都在持續進行中,并受到了業內的廣泛關注。
表2:2011年-2014年國家基藥不良反應報告情況
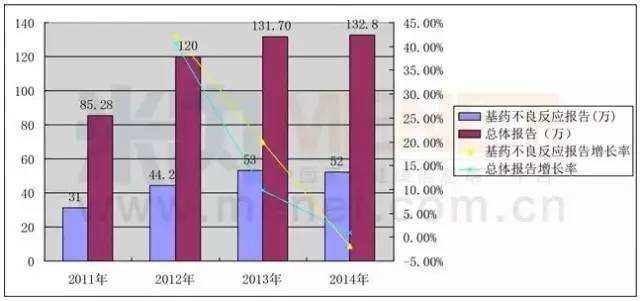
據《國家藥品不良反應監測年度報告(2014年)》數據顯示,2014年全國藥品不良反應監測網絡共收到國家基本藥物的不良反應/事件報告52.0萬例(占2014年總體報告的39.2%),其中嚴重報告2.9萬例,占5.6%。報告涉及化學藥品和生物制品病例報告占82.9%,中成藥病例報告占17.1%。不良反應報告增長率逐年下降,2014年出現了負增長。
CFDA會根據藥品不良反應監測的風險信號,組織對出現問題的基本藥物開展安全性評價,并采取了相應風險控制措施。對業界而言,這項行動無疑是一張“糾錯表”,同時也能督促企業改進生產技術,進一步提高藥品的安全性。
迫在眉睫的電子監管碼
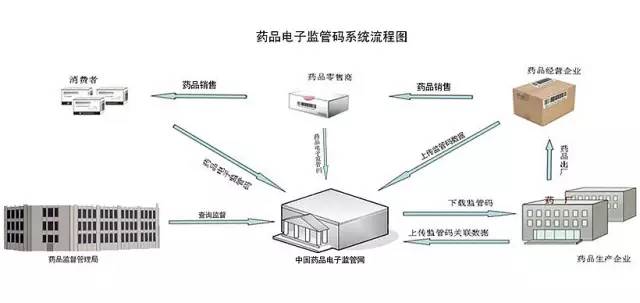
按照國家食品藥品監管總局的部署,2015年底前,國內藥品必須實現所有制劑品種全部賦碼入網,從2016年1月1日起生產的產品包裝上都必須有電子監管碼。
業界對此曾有憂慮。中國醫藥商業協會一位內部人士曾指出,這將增加企業賦碼、核注核銷的工作量,增加人工和技術改造的費用,生產和經營企業當時更多關注成本問題。而江蘇鹽城蘇好大藥房有限公司執行董事蔡文兵也曾表示為,“要做到對每盒藥品的電子監管碼核注核消需要增加不少成本,包括藥品電子監管碼智能掃碼槍、入網密鑰等軟硬件投入,恐怕是一個大數目,這也是政策推動緩慢的原因。”
“電子監管碼”是藥品獨一無二的“身份證號碼”,給消費者吃了一顆“安全定心丸”,對于藥監人員來說,也是不可多得的助手,可追溯藥品渠道、追查藥品流向,從而有效打擊違法購進行為,讓假藥無處遁形,更好地規范藥品市場秩序。政策在進一步理清藥品流通環節的同時,也為醫藥企業優化渠道管理提供了機遇。
信息來源:上海醫藥商業行業協會
|