注冊困境、限價壓力……中藥何去何從?
日期:2015/11/13
觀望期已過,各種痼疾或問題即將搬上臺面,需精斟細酌政策里的“黃金”。

屠呦呦教授的諾貝爾獎讓中醫藥行業突然揚眉吐氣起來,似乎忘卻2011年至今平均每年中藥新批文不足120個的注冊困境,似乎忽略此前的中藥注射劑“神藥”說,更不用提因醫保費用過多支付在中藥類產品導致的中藥臨床療效信任危機。
在醫院限制藥品目錄、醫保控費、獨家產品面臨議價等政策之下,中成藥在醫院的銷售越發困難。口服類中藥產品的銷售主戰場依然是藥店,補益類特別是阿膠的產品成為主要增長點。但是問題來了:阿膠究竟是藥材呢還是保健品?“瑪卡”式神藥營銷是否也適合于中藥?中藥OTC面臨新廣告法的沖擊,未來中藥古漢語式的功效描述如何讓購藥者理解?
另一方面,部分中藥材供不應求,有效成分含量卻不能保證,更是加大了企業的成本。CFDA頻頻飲片和中藥提取車間飛檢,銀杏提取物事件體現了CFDA對中藥提取物開始嚴格控制管理。
此外,中藥研發新藥面臨如何通過臨床試驗證實其療效(通過臨床終點)的考驗。應對中藥再評價的挑戰,對于現有藥物特別是中藥注射液而言,大健康或許是出路,但除了云南白藥的牙膏案例,還有多少能夠支撐中藥藥企轉型的成功案例?
“十二五”規劃的關鍵是推動我國自主知識產權、技術先進、成熟度高的中藥產業化,支持療效確切、可供臨床選擇的中藥新產品走向市場。根據《科技部發布國家“十二五”科學和技術發展規劃》(下稱科技部“十二五”規劃)和《國家中醫藥管理局關于印發中醫藥事業發展“十二五”規劃的通知》(下稱中醫藥“十二五”規劃),重點支持10余個中藥材大品種的深度開發,開展8-10個新藥品種的研發,30個傳統中藥大品種的二次開發。

按咸達數據V3.2,2011-2015年,中藥新獲批生產的產品批文數有218個,從數量而言完成目標。江蘇康緣以6個批文數排名所有企業中的第一,第二和第三都是西藏的廠家,分別是西藏昌都光宇利民藥業有限責任公司和西藏金哈達藥業有限公司。
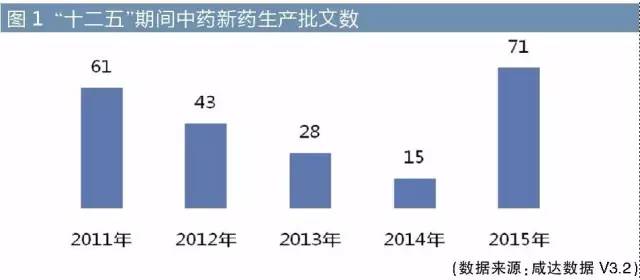
完善中藥注冊作為“十二五”規劃的任務之一,按中醫藥“十二五”規劃,要求選擇中醫藥具有療效優勢的30種常見病,對其中醫藥診療手段和方法等進行系統整理研究,形成規范并加以推廣。重點加強心腦血管病、糖尿病、惡性腫瘤、慢性呼吸系統疾病、腎病等重大慢病和艾滋病、病毒性肝炎、新發傳染病以及婦女兒童健康問題等的中醫藥防治臨床研究,建立有中醫藥特點的療效評價標準,形成具有國內外公認循證證據的高水平綜合防治方案。到2015年,力爭有3個現代重大疑難疾病防治達到國際領先水平。
心腦血管疾病和呼吸系統中成藥,是“十二五”期間獲批中藥生產批文數較多的疾病領域。其中,中藥有效成分單體藥逐漸增多,如3個注射液銀杏二萜內酯葡胺注射液、銀杏內酯注射液和注射用丹參多酚酸,獲批的廠家現在都屬于上市企業;口服心腦血管疾病中成藥有蒺藜皂苷膠囊,口服呼吸系統中成藥有穿心蓮內酯軟膠囊、川射干黃酮膠囊。
相對于化藥對糖尿病藥DDP4和抗腫瘤藥替尼的開發熱情,中藥對糖尿病和惡性腫瘤領域方面的熱情可謂云泥之別。“十二五”期間的糖尿病中成藥獲批的只有五黃養陰顆粒和消糖靈顆粒,抗腫瘤的主要有芪黃顆粒、復方鹿仙草膠囊和秘訣清涼膠囊。
平均下來,重點領域每年獲批的新藥不夠10個,這與現在中藥審批越來越傾向于參考化藥的臨床標準有關。根據2011年CFDA發布了《中藥、天然藥物治療冠心病心絞痛臨床研究技術指導原則》、《中藥、天然藥物治療女性更年期綜合征臨床研究技術指導原則》,臨床指標既參考歐美的指南又考慮中醫診斷標準和治療準則,對藥物的有效性有較高要求。對于有效成分并不是完成單一化合物的中藥而言,臨床療效的門檻有點高,但作為現代藥物研究體系而言,立此門檻又是必須的。
根據中醫藥“十二五”規劃,通過支持中藥工業生產技術、裝備的研發與應用,構建體現中藥特點的生產、研發技術平臺;支持中藥生產關鍵技術成果的應用,打造一批知名中藥企業。科技部“十二五”規劃則將相關目標細化,重點提及中藥提取純化技術、中藥制劑技術、生產過程控制技術和中藥飲片生產技術,以及藥用輔料、藥用包裝材料和制藥設備。

考核指標確定行為導向。中藥企業除了中藥注射液生產廠家之外,真正愿意投資在中藥提取以外新工藝技術的中藥口藥生產廠家并不多。
這不僅僅是出于成本考慮,更大的原因在于,中藥企業在工藝的投資更多是為了應付2010年版GMP要求,GMP又偏偏對中藥提取和注射劑劑型有高標準,加上CFDA數據增設中藥提取物備案公示,銀杏葉提取物事件、中藥提取車間頻頻GMP飛檢等,體現了國家對中藥提取工藝的高要求,因此中藥企業最愿意投入改造的工藝為中藥提取工藝。
此外,2015年版藥典顯示出國家對藥用輔料的高要求,預計隨著輔料強制備案制的執行,中藥企業也會越來越重視中藥藥用輔料方面的投入。
中藥標準的提升,在“十二五”規劃中是重中之重,以中藥材與中藥飲片的質量標準為重點。《國務院關于印發國家藥品安全“十二五”規劃的通知》除了要求中藥標準主導國際標準制定,還要求到“十二五”末各級檢驗機構的檢驗能力提升。科技部“十二五”規劃更關注中藥材規范化種植、中藥配方顆粒質量標準、中藥藥效物質研究及中藥質量評價等關鍵技術。中醫藥“十二五”規劃要求推進實施中藥材生產質量管理規范,繼續加強中醫藥標準制修訂工作,初步建立中醫藥標準體系,到2015年發布實施中醫藥國家標準和行業標準300項。
與中藥材與中藥飲片質量體系建設規劃配套的政策有建立中藥材基地、中藥資源普查、探索建立中藥材流通追溯體系等,目標在于從源頭管控中藥材。推動中藥材基地的建立則是源頭的第一步。中藥材生產質量管理規范(GAP)認證依然屬于CFDA保留的行政審批項目,《國務院對確需保留的行政審批項目設定行政許可的決定》(國務院令第412號)附件第352項,GAP屬于CFDA總局牽頭實施的29項行政審批事項目錄之一。CFDA認為GAP基地的認證仍值得保留,可見其對藥材種植的重視。
但是,目前過GAP認證的記錄依然不多。截至2015年10月23日,根據CFDA食品藥品審核查驗中心數據,2011年以來過GAP認證的記錄共135條。
在為數不多的記錄中,個別企業通過GAP認定后便放松了對GAP基地的管理,規范化“名不副實”。此外,野生中藥材的馴化需要一個長期的過程,歷史上成功案例也并不多,盲目引進外地藥材種植可能導致藥材的道地性喪失,有效成分部位或有效成分的含量可能改變,甚至可能低于國家藥典標準。若藥材有效成分低于藥典含量則屬于假藥,相關質量負責人可能面臨刑拘的懲罰。當年定的高標準若難以維持,最終GAP基地將會荒廢。
中藥材流通追溯體系方面,CFDA對藥材的監測越來越嚴,除了要求每個環節出示有效成分含量的指紋圖譜,對非法添加劑要求也提高,如銀杏葉提取物不得含有槐角苷,中藥材及中藥飲片不得檢出金胺O等。2015年版藥典對藥材農藥殘留的檢測方法,顯示國家對藥材農藥殘留問題的重視,也從側面反映出國內藥材種植規范化之路還有很長的路要走。
天然藥物究竟是不是中藥?中藥注射劑是否“神藥”?中藥是否一定要受中醫思想指導用藥?這些問題的爭論時常有之。但是,目前對于中藥產業而言,更重要的是要找到能讓企業生存下去的方向。這個方向除了要能應對目前日益增長的成本費用(藥材費用、檢測費用、標準提升配套設施購買費用),還要能在終端市場上滿足使用者的需求,最終獲得企業能持續發展的利潤。
中藥,在新一代的消費者中應該是以怎樣的形象存在,養生、預防還是治療?怎樣的中藥產品才是消費者、人社部門愿意掏腰包購買的?現有的中藥要滿足購買者需求,需要做什么事情?怎樣的中藥項目值得投入資源進一步開發?
時至今日,真的是時候刨根問底了,以上種種問題已避無可避!
根據“十二五”規劃的目標,中藥工業總產值2010年是3172億元,預計2015年增長至5590億元,年均增長率為12%。而按工信部現頒布數據,2015年上半年中藥飲片加工業收入757.00億元,同比增長12.04%;中成藥制造工業收入2796.02億元,同比增長5.20%。因此,筆者預計2015年能夠完成總產值目標,但增長率的放緩可能讓“十三五”的目標下調。
中藥質量體系未來規劃
對于中藥材和中藥飲片質量體系建設的未來規劃,2015年發改委發布的《國家發展改革委關于實施新興產業重大工程包的通知》內的內容預計也是“十三五”的重要目標。
2015年著重于中藥標準化建設方面,建設涵蓋50%以上中成藥大品種的優質產品標準和50%以上臨床最常用中藥飲片的等級標準,形成我國重點中藥優質產品標準體系。鼓勵中藥骨干企業聯合產業鏈上下游企業和科研機構形成鏈。國家中醫藥管理局組織項目遴選和制定項目實施方案并組織實施,發改委根據項目實施方案及項目進展情況給予滾動支持。2015年8月底前將項目報送至國家中醫藥管理局。申報重點中藥優質產品標準中的中成藥品種的,該品種近3年年均銷售額應不少于3億元,牽頭企業年均銷售總額應不少于10億元;申報飲片品種的,牽頭企業近3年累計銷售收入應不少于2億元。各品種申報所涉及的相關產業鏈須有較好的銜接,鼓勵產學研聯合或聯盟申報。
2016年著重于支持中藥標準化支撐體系建設方面,建設涵蓋常用中藥材、中藥飲片及中成藥的實物樣品、定性定量信息和特征圖譜庫等的中藥質量標準庫。建設第三方質量檢測技術平臺,在南北不同區域組建2家中藥質量第三方檢驗機構,開展優質中藥種子種苗、中藥材、中藥飲片、中成藥品種等的質量檢測等工作。
2017年著重于建立中藥優質產品信息定期公告機制,建立優質中藥品種的行業認證體系。在利用第三方質量檢測平臺的基礎上,建立優質中藥品種的行業認證體系,引導行業協會、產業聯盟或第三方機構發布中藥產品質量信息,形成中藥標準化建設的長效機制。
信息來源:醫藥經濟報
|