|
|
|
27家藥企國際認證失敗
日期:2015/11/24
導讀本文作者為大家帶來2015年度印度制藥企業國際認證失敗的案例解析,本文數據來源主要來自FDA警告信數據庫、歐盟GMP檢查數據庫和加拿大官方檢查數據庫,來看下具體詳情。
話說2015年在中國制藥行業發展史上,注定是一個不平凡的年頭;同樣,對于印度制藥企業,估計更不是一個平靜的年頭。從目前掌握的公開數據看,2015年度印度制藥企業被國際藥政機構檢查和警告的例子,遠遠大于中國制藥企業。到2015年11月初,印度制藥企業在針對美國FDA、歐盟各藥政機構、加拿大官方檢查中,已經有多家制藥企業未通過檢查,被發現有嚴重缺陷。筆者匯聚和解析這是失敗的案例,期望為意圖開拓國際市場的中國制藥企業提供教訓和值得參考的地方。 本文數據來源主要來自FDA警告信數據庫、歐盟GMP檢查數據庫和加拿大官方檢查數據庫。
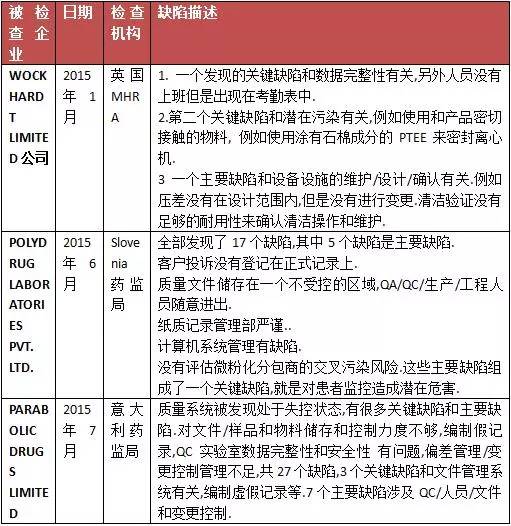
第一部分:歐盟檢查數據庫信息匯總
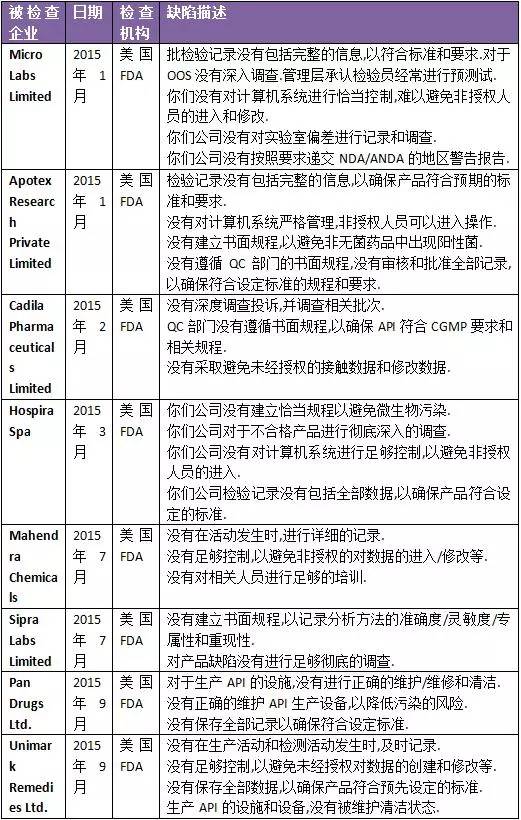
第二部分:FDA警告信數據匯總
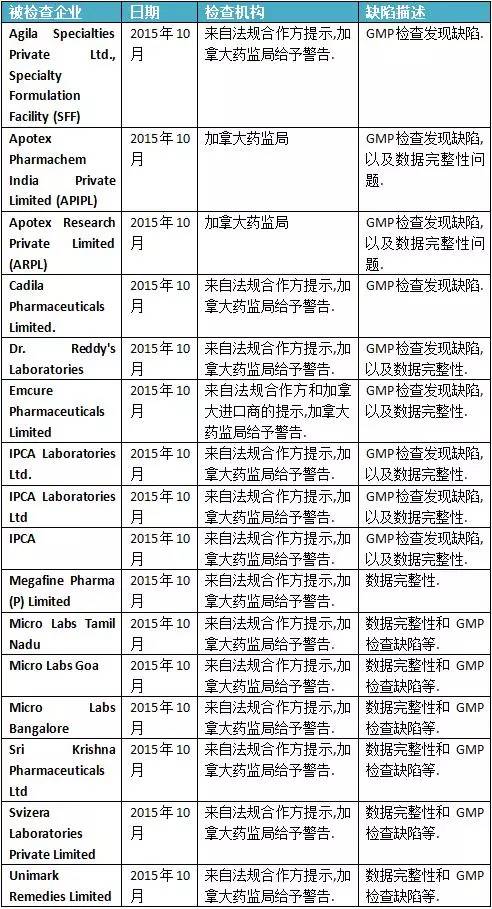
第三部分:加拿大官方檢查數據信息匯總
匯總解析
綜合分析上述的各官方機構的警示信息,可以發現印度制藥企業發生的缺陷,主要集中于如下領域:第一. 計算機系統管理不善.不管是計算機系統的采購,還是計算機系統的驗證和日常管理,都存在很多管理不善的環節.第二. 對廠房設施和設備維護不利,導致生產藥品的硬件條件不符合要求.我們可以看到,多家印度制藥公司的問題,都涉及硬件缺陷.第三. 記錄不及時.GMP基本要求,就是要及時記錄生產活動和檢驗活動.如果不及時記錄,記錄真實性就會被質疑.第四. 沒有遵循自己的規程.多家印度制藥企業的QC被發現沒有遵循規程,或者對產品缺陷,沒有進行深入調查. |
|





