淺論制藥企業中計算機化系統管理內容
日期:2015/11/27
淺論制藥企業中計算機化系統管理內容
先亮 啊娜
摘要:本文結合國內外制藥行業計算機化系統相關規范及指南,探討了制藥企業開展計算機化系統管理的12個方面內容,并就各方面管理內容提出了看法和建議,為制藥企業落實計算機化系統GMP管理提供參考。
關鍵詞: 計算機化系統;GMP;制藥企業
Elementary discussion about management of computerized system in pharmaceutical company
Xianliang, A Na
ABSTRACT: To provide reference for the implementation of computerized system GMP management for pharmaceutical company, the management of computerized systems of pharmaceutical company in 12 aspects were discussed, and the opinions and suggestions on the management of the various aspects were presented in this article, based on specifications and guidelines for the computerized system of pharmaceutical industry at home and abroad.
制藥行業
KEY WORDS: computerized system; GMP; pharmaceutical company

近期國家食品藥品監督管理總局發布《藥品生產質量管理規范(2010年修訂)》附錄《計算機化系統》【1】,于2015年12月1日執行,該附錄的實施將進一步規范制藥行業計算機化系統管理,使其控制下的產品質量更加可靠。該附錄對藥品生產質量管理過程中應用的計算機化系統應有的基本管理事項進行了要求,并未對管理事項的具體細節進行描述。本文結合美國注射劑協會(PDA)的計算機相關系統的驗證、國際制藥工程協會(ISPE)的GAMP5、國際藥品認證合作組織(PIC/S)在GxP環境下的計算機化系統合規實踐指南(PI011-3指南)等規范及指南,結合國內制藥企業基本現狀,詳細闡述了計算機化系統管理內容及開展方法,以有益于制藥企業落實GMP附錄《計算機化系統》的各項要求。
1. 計算機化系統定義及范圍
2010年版附錄《計算機化系統》對計算機化系統的說明為:“計算機化系統由一系列硬件和軟件組成,以滿足特定的功能”。 PIC/S的PI011-3指南中的定義:計算機化系統由計算機系統和被其控制的功能或流程組成。GAMP5中定義:計算機化系統由硬件、軟件、網絡組件和可控的功能和相關文件組成。GAMP5的定義界定的范圍更加精準一些,計算機化系統不同于計算機系統,其涵蓋計算機系統及被其控制的功能及流程。
綜合上述定義,計算機化系統是指在適宜的計算機系統的基礎上,將這種系統與具體的工藝或操作相結合,實現最終管理和控制目標的系統。對于藥品生產質量控制而言,就是將具體的生產工藝和質量控制操作步驟在相關軟件的全面監控下和硬件元件的參與下按照相關的規程進行運轉,從而實現管理的自動化、無紙化和集成信息化【2】。計算機化系統的組成關系圖表示如圖1:
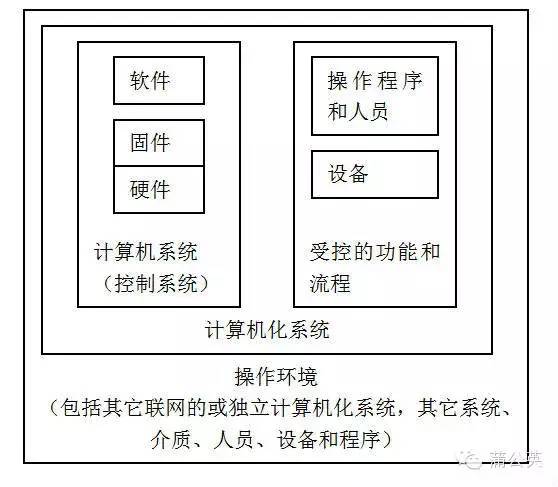
圖1 計算機化系統的組成關系圖
2. 管理責任部門界定
職責不清、推諉扯皮導致工作效率降低,無形中增加企業的管理成本,所以在制藥企業推進計算機化系統管理,需要將計算機化系統的主要管理責任部門進行明確。結合國內制藥企業實際情況,可將計算機系統分為三類,分別由三個部門作為管理第一責任部門:IT部門管理一些純軟件系統,或主要部分是軟件的系統,如ERP、LIMS、QMS;工程部門管理與設備集成在一起的系統,常見的如PLC;質量部門管理實驗室儀器相關的系統,如色譜數據工作站。
上述三類計算機化系統的管理原則和內容,GAMP5中有專門的、細化的指導文件:
a. IT部門管理的純IT系統,參考GAMP: A Risk-Based Approach to Compliant GxP Computerized Systems。
b. 工程部門管理的工程IT系統,參考GAMP GPG: A Risk-Based Approach to GxP Process Control Systems。
c. QA管理的實驗室IT系統,參考GAMP GPG: A Risk-Based Approach to GxP Compliant Laboratory Computerized Systems。
3. 計算機化系統的分類
根據計算機化系統定義,制藥企業內的計算機化系統應用極為廣泛【3】,涵蓋小至電導率儀、pH計,大至電子監管碼系統、生產資源計劃系統(ERP),數量龐大,種類繁多,需要將其進行分類,做到復雜系統重點管理,簡單系統簡化管理,以避免不必要的管理成本的投入,做到精益生產。
類別1:嵌入式計算機系統。該類計算機化系統特點:沒有用戶界面,產生原始數據及測試結果但不存儲及處理;軟件程序固化在系統的內部存儲器中;可以輸入并儲存運行參數,但不能對軟件進行修改和配置。
舉例:
a. 現場安裝的智能化傳感器、顯示儀(嵌入式計算機)
溫度、壓力、流量、風速、轉速、pH、電導率等。
b. 現場安裝的智能化儀表自動控制系統(嵌入式計算機)
溫控儀、壓力控制器、帶調節信號、報警信號的智能儀表等
c. 電子衡器、數顯式檢驗檢測儀器、測試工具、離線儀表等。
類別2:工業過程控制類計算機系統。該類計算機化系統特點:有單一用戶界面,配置參數可存儲及再使用,但軟件不能進行配置;產生原始數據及測試結果存儲及處理,具備顯示、控制功能。
舉例:
a. HMI+PLC控制系統
生產工藝設備(反應釜、配液罐、洗烘灌軋聯動線、滅菌柜【僅帶PLC操控】、粉碎機、制粒機、混合機、壓片機、膠囊機、洗瓶機、灌封機等);純化水系統、注射用水系統、純蒸汽系統等
b. IPC工業計算機控制系統
計算機+IO接口(工業控制總線)+輸入輸出信號
類別3:單界面數據分析處理類計算機系統。該類計算機化系統特點:有單一用戶界面,配置參數可存儲及再使用,但軟件不能進行配置;產生原始數據及測試結果存儲及處理,具備顯示、控制、軟件數據處理、貯存功能。
舉例:
a. 實驗室設備計算機控制/數據采集處理分析系統
HPLC(液相)、GC(氣相)、IR(紅外光譜)、UV(紫外)、CDS色譜工作站等
b. DCS系統
集散(分布)式控制系統,工廠級過程自動化控制。
計算機+系統網絡+計算機+工業總線+現場控制器+IO接口+輸入輸出信號組成。
舉例:帶電腦控制、數據分析的滅菌柜系統。
c. SCADA系統
即分布式數據采集和監控系統,它集中了PLC系統的現場測控功能和DCS系統的組網通訊能力兩大優點,性價比高,主要用于大系統、大量、甚至遠程數據的采集和監控。
舉例:潔凈區環境監測控制系統。
類別4: 多界面管理類計算機化系統。該類計算機化系統特點:多個用戶界面,配置參數可存儲及再使用;產生原始數據及測試結果存儲并有應用軟件處理,具備顯示、控制、軟件處理數據、貯存功能。
舉例:
LIMS系統:實驗室信息管理系統;倉庫物料管理系統;GMP質量管理系統;ERP類企業資源計劃管理系統;電子監管碼系統等。
4. 計算機化系統清單管理
為便于公司內部計算機化系統管理,建立一個及時更新的計算機化系統清單是必須的。企業建立該清單應符合下面幾項要求:
4.1. 清單應包含藥品生產質量管理過程中涉及的所有計算機化系統清單,該清單可以GMP文件管理模式編號管理。
4.2 計算機化系統清單內容應至少包括:系統名稱,安裝位置,硬件名稱、軟件名稱,與藥品質量管理相關功能,類別等項目。此處的類別應根據本文上述分類原則確定。
4.3 計算機化系統清單應在公司計算機化系統出現新增、報廢、安裝位置變更、軟件升級、功能變動等情況出現時及時變更。
5. 計算機化系統供應商管理
制藥企業均按照GMP規定建立了原輔料供應商管理規程,計算機化系統供應商的管理操作規程可以參照其建立。計算機化系統供應商的管理應注意:
5.1制藥企業應根據風險級別及計算機化系統的類別建立計算機化系統供應商檔案,對于在生產質量控制及管理中起重要作用、屬類別2、類別3及類別4的計算機化系統必須建立完善的供應商檔案,檔案的內容應包括供應商的聯系方式及聯系人、供應商介紹、供應商資質證明、供應商審計記錄及批準報告、質量保證協議等等。
5.2 計算機化系統供應商審計也需要根據風險級別及計算機化系統的類別開展。審計團隊應包括使用部門、設備管理部門、IT部門、質量管理部門的技術人員。審計方式可以采取三種方式:a. 歷史經驗(基于可用信息的判斷),對有經驗的企業、集團企業來說是比較好的,一個子公司的審計結果可以集團內共享;b. 調查問卷郵寄審計;c. 現場審計,此種審計費用較高,但是對于風險級別較高、系統復雜的計算機化系統供應商,開展現場審計是非常必要的。供應商審計應主要關注供應商的質量體系、軟件開發項目管理、軟件開發方法、測試、配置管理、制造、項目實施管理、現場變更管理、GMP實施經驗、文檔管理、安全管理、培訓管理、售后支持等。
6. 計算機化系統驗證
計算機化系統的驗證范圍與程度應當基于科學的風險評估。風險評估應當充分考慮計算機化系統的使用范圍和用途。原則上,類別1及類別2的計算機化系統,具備顯示及控制功能,無獨立的應用軟件操作系統,該類計算機化系統應重點確認其顯示及控制功能的準確性,和設備運行確認一并進行。類別3及類別4的計算機化系統,具備顯示、控制、軟件數據處理、貯存功能,具有獨立的應用軟件操作系統,該類計算機化系統驗證應包括硬件確認及軟件驗證【4】。計算機化系統的確認總體框架同普通設備確認一樣,包括設計確認(DQ)、安裝確認(IQ)、運行確認(OQ)及性能確認(PQ),但是計算機化系統確認的特點在于除了對系統硬件確認之外,還應當著重對系統的軟件進行確認,包括顯示、控制、數據的采集及存貯、數據處理、貯存、報警、安全控制、斷電/修復、災難恢復等等。具體的驗證內容,梁毅【4】、薛師帥【5】有詳細的論述。
7. 計算機化系統安全管理
計算機化系統的安全和數據的安全在GxP管理中是非常重要的。用于備份的儲存設備或介質和備份的程序要保證數據的完整性。有關備份操作的SOP須描述備份的頻率、備份復本保留的時間、定期備份的方法和職責,備份復本的保管。【6】
不管是小的還是復雜的計算機化系統都要求清晰的定義系統安全管理的職責,并且滿足以下要求:
a. 明確并設置所有人員訪問計算機化系統的權限,包括:物理訪問和邏輯訪問。并通過使用人員密碼、通行證和制定相關的規定來控制。幾次登陸系統不成功后,如:密碼輸入不正確,有禁止再次嘗試訪問的措施。
b. 至少有兩個超級用戶管理每臺計算機系統,并且不能同時出差或休假,若必須,則進行臨時授權,出差或休假完成后立即收回。
c. 定期對識別碼、密碼進行檢查,有核對的程序。定期修改識別碼、密碼。
d. 有人離崗離職,該人使用的計算機系統要進行一次安全性評價與變更。
e. 如果一個計算機系統不再使用,要保證5年內至少有一臺儀器能夠打開原有的資料。
8. 計算機化系統使用維護
制藥企業要建立計算機化系統的日常使用維護的管理制度(SOP)和軟硬件的設備日志。定期對計算機化系統進行檢查、維護保養。維護保養的內容根據計算機化系統的不同而不同,如數據整理、備份等,并形成記錄。應在計算機化系統使用維護SOP中規定系統出現故障或損壞時的應急預案及進行處理的方式及程序,必要時對該操作方式及程序的相關內容進行驗證,問題及處理應形成記錄,記錄的內容至少包括:問題描述、問題發生的日期、采取的行動、執行人、采取行動的日期和相關的改變控制的管理文件。問題處理的過程必須參照偏差控制的管理程序以確定問題的潛在影響。
9. 計算機化系統的變更
計算機化系統在設計、安裝、運行、使用的過程中,根據實際情況可能發生改動,與原規程不一,包括:安裝位置變更、硬件改變、軟件升級、關鍵參數的變更、功能變動等。變更情況出現時,應按照GMP要求及企業的變更控制程序,記錄變更的原因,分析執行變更后對系統狀態和控制的影響,審核變更的內容,記錄變更的審核過程,全面評價變更的方案,包括評價其技術價值、潛在的副作用、對其他配置對象和系統功能的綜合影響、GMP風險。對已驗證的計算機化系統進行任何改變都要經系統使用者和QA人員審批。變更后要進行確認并形成記錄。
10. 電子記錄管理
根據美國FDA 21 CFR Part 11, 電子記錄(Electronic Records )是指任何由計算機系統產生、修改、維護、歸檔、提取和分發的文字、圖形、資料、聲音、圖像或其它以數字形式存在的信息集合。電子記錄的管理必須滿足GMP 對記錄的要求,即真實、及時與規范。隨著計算機化系統在制藥行業的廣泛應用,一些優秀的軟件設計商已經將電子記錄設計的符合GMP要求。作為制藥企業,需要制定電子記錄的管理規程,規范電子記錄的管理,在電子數據和紙質打印文稿同時存在的情況下,明確規定以電子數據為主數據還是以紙質打印文稿為主數據。以電子數據為主數據時,應當滿足以下要求:【1】
10.1 為滿足質量審計的目的,存儲的電子數據應當能夠打印成清晰易懂的文件。
10.2 必須采用物理或者電子方法保證數據的安全,以防止故意或意外的篡改或損害。日常運行維護和系統發生變更(如計算機設備或其程序)時,應當檢查所存儲數據的可訪問性及數據完整性。
10.3 應當建立數據備份與恢復的操作規程,定期對數據備份,以保護存儲的數據供將來調用。備份數據應當儲存在另一個單獨的、安全的地點,保存時間應當至少滿足本規范中關于文件、記錄保存時限的要求。
11. 電子簽名管理
電子簽名( Electronic Signature )則是指經計算機編輯的由某人使用、承認或授權,與其手寫簽名在法律上具有同等地位的任何符號或符號串。對于電子簽名的管理,一方面要符合《中華人民共和國電子簽名法》的相關要求:電子簽名必須同時符合“電子簽名制作數據用于電子簽名時,屬于電子簽名人專有”、“簽署時電子簽名制作數據僅由電子簽名人控制”、“簽署后對電子簽名的任何改動能夠被發現”、“簽署后對數據電文內容和形式的任何改動能夠被發現”等幾種條件,其表現形式可以是手寫簽名、公章的“電子版”、秘密代號、密碼或指紋、聲音、視網膜結構等【6】。另一方面,還要結合制藥行業特點,對電子簽名的權限設置和復核流程的設計,如何確保安全值得考慮。在制藥企業里使用公章的“電子版”和手寫簽名設計比較合適,將簽名設置在軟件中的固定模塊里,計算機化系統應有識別非授權使用電子簽名和ID密碼的程序,使用電子簽名訪問系統時,有程序提醒訪問系統所從事的活動與該電子簽名所對應的職責相匹配。企業應建立規范電子簽名的管理制度,避免偽造記錄和簽名。
12. 計算機化系統引退
當一個計算機系統的現行功能實施不再適用,或執行一個新系統替代現有系統的功能時,該系統就從實際使用中引退。
12.1 引退系統
應制定一個工程計劃以確定引退工作的步驟、鑒別將要替代原有系統的新系統、引退過程的期限及相關責任。確定原系統數據是否應按照一定的格式存檔。如果原系統被另一個系統替代,存檔的數據應該被裝載在替代系統中,數據成功轉移的確認是新系統驗證的一部分。
系統引退時,應通知到所有受影響的用戶,并完成以下工作。
a.撤銷系統特殊的程序。
b.切斷系統通道。
c.整理系統所有邏輯值、符號和菜單參考。
d.刪除所有軟件和工作環境下存檔的電子記錄。
12.2 系統引退報告
系統引退報告用于總結整個系統引退工作的實際執行結果,確認是否按要求正確實施引退活動。
13. 結語
“計算機化系統”在GMP 管理中的應用是未來藥品生產與質量管理的必然趨勢,我國目前處于起步階段,《藥品生產質量管理規范(2010年修訂)》附錄《計算機化系統》的發布,使制藥企業在規范計算機化系統管理上“有法可依”,但是如何結合制藥企業的特點,深入細化的開展計算機化系統的全面管理,有必要對其現狀和進一步實施的內容和細節進行更多的研究,建立一整套全面、細致的計算機化系統管理制度,使我國制藥企業計算機化系統管理盡快趕上發達國家的水平,增強企業的競爭力,加快我國醫藥產業國際化的步伐。
參考文獻:
[1]國家食品藥品監督管理總局關于發布《藥品生產質量管理規范(2010年修訂)》計算機化系統和確認與驗證兩個附錄的公告(2015年第54號)
[2]王燕,梁毅.計算機化系統在GMP管理中的應用[J].醫藥工業設計,2009,30(5):30-33。
[3]楊顯梅,李 靖.計算機化系統在制藥行業的應用[J].中國新技術新產品,2013,20(10):27。
[4]梁毅,張玉倩,王燕. 論藥品生產企業計算機化系統的驗證[J].機電信息, 2013,389(35):9-13
[5]薛師帥,肖玉良,唐洪剛. 開展計算機化系統驗證 提升質量管理水平[J].電大理工,2011,248(3):51-53
[6]楊瑞青. 制藥行業中的計算機化系統的管理[J].醫藥工業設計,2006,27(6):22-25
信息來源:蒲公英
|