長效口服降糖DPP-Ⅳ抑制劑PK進行時,國內企業搶仿曲格列汀
日期:2015/12/30

最近發展起來的長效口服DPP-Ⅳ抑制劑,由于每周僅需給藥1次而提高了患者的便利性和依從性,其臨床價值和臨床地位或將有望提升,并將以其獨特的優勢有望在競爭激烈的口服降糖藥市場中突飛猛進。
糖尿病是一種常見的慢性代謝性疾病,2型糖尿病占所有糖尿病的90%。近年來,全球糖尿病患者增加迅速。來自國際糖尿病聯盟(IDF)2015年最新發布的數據顯示,目前全球共有4.15億糖尿病成年患者,3.18億人存在糖尿病風險。我國是世界上糖尿病患者數最多的國家,目前患者人數已達1.1億。預計到2040年,全球將有6.42億人患有糖尿病,與目前數據相比增加超過50%。據WHO估計,2005~2015年,我國因糖尿病及相關心血管疾病導致的經濟損失達5577億美元。由此可見,糖尿病不僅給患者帶來身體及精神上的損害并導致壽命縮短,還給家庭和國家帶來沉重的經濟負擔。
盡管在過去的20年問世了一系列新的口服降糖藥和胰島素制劑,但2型糖尿病仍未得到有效控制。二肽基肽酶IV(DPP-Ⅳ)抑制劑是近10年發展起來的新型口服降糖藥。于2006年8月首獲墨西哥藥品管理當局批準的西格列汀(Sitagliptin,Januvia?)是首個獲準上市的DPP-Ⅳ抑制劑,西格列汀的上市拉開了DPP-Ⅳ抑制劑進軍糖尿病市場的帷幕,也催生了該類藥物的發展。保守估計,2015年全球糖尿病藥物市場達300億美元,而DPP-Ⅳ抑制劑將以100億美元的市場份額高位占居。
DPP-Ⅳ抑制劑通過抑制腸促胰素的DPP-Ⅳ酶的活性而發揮作用,其通過競爭性結合DPP-Ⅳ活性部位,降低DPP-Ⅳ的催化活性,抑制GLP-1的降解,從而增加血液中GLP-1的濃度。DPP-Ⅳ抑制劑因降糖效果強,且可保護胰島功能,安全性良好而倍受臨床青睞。然而,最近發展起來的長效口服DPP-Ⅳ抑制劑,由于每周僅需給藥1次而提高了患者的便利性和依從性,其臨床價值和臨床地位或將有望提升。盡管口服降糖藥林林總總,但長效口服DPP-Ⅳ抑制劑將以其獨特的優勢有望在競爭激烈的口服降糖藥市場中突飛猛進。迄今為止,已有兩個長效口服DPP-Ⅳ抑制劑應用于臨床,這兩個藥物分別是于2015年3月26日和2015年9月28日獲日本醫藥品與醫療器械綜管理局(PMDA)批準的琥珀酸曲格列汀(Trelagliptin Succinate,SYR-472)和奧格列汀( Omarigliptin,MK-3102)(有關這兩個產品的基本信息詳見表1)。盡管上述這兩個產品均尚未在歐美等主流國家或地區上市,但曲格列汀和奧格列汀已在日本開展一場PK大賽,孰將于這場PK大賽中奪冠我們拭目以待。
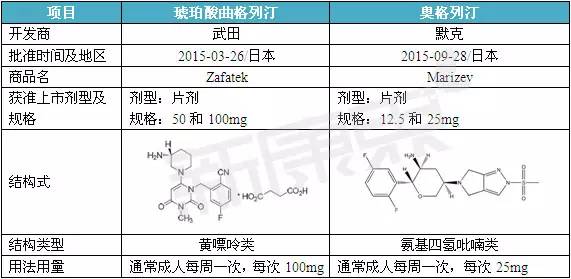
| 曲格列汀-首個獲準上市的長效DPP-Ⅳ抑制劑
由武田公司研發的曲格列汀是全球首個獲準上市并應用于臨床的長效DPP-Ⅳ抑制劑。曲格列汀通過選擇性、持續性抑制DPP-Ⅳ從而達到控制血糖水平,減少糖尿病并發癥的發生。 體外研究結果顯示,與其它每天給藥一次或二次的DPP-Ⅳ抑制劑相比,低濃度的曲格列汀即可有效地抑制DPP-Ⅳ的活性。例如,體外相同條件下的曲格列汀和曲格列汀的IC50值分別為1.3nM和5.3nM。曲格列汀的半衰期約為38~54h,其對DPP-Ⅳ的抑制作用可長達給藥后168h(7d),這為其作為每周給藥一次奠定了強有力的理論依據。在日本2型糖尿病患者中進行的臨床研究結果顯示,患者經曲格列汀單劑量治療24周后,糖化血紅蛋白(HbA1c)水平和空腹血糖水平均得到有效改善。曲格列汀安全性和耐受性較好,主要不良反應有低血糖(與其它降糖藥物聯合使用時)和鼻咽炎等。曲格列汀對體重不產生影響,不會出現頻繁的低血糖事件。總之,在日本進行的臨床試驗證實,每周一次的曲格列汀的療效和耐受性與每日給藥一次的阿格列汀相仿。
曲格列汀目前僅在日本上市。考慮到進入歐美等主流市場費用昂貴,武田公司現已放棄開拓歐美市場。然而,在日本上市不久的曲格列汀已表現出強有力的市場潛力。來自武田公司的數據顯示,曲格列汀上市后的第一銷售季其銷售額已達20億日元。
| 奧格列汀-奔赴全球市場的新星
奧格列汀由默克公司開發,是全球第二個獲準上市的長效DPP-Ⅳ抑制劑。與曲格列汀相仿,奧格列汀對DPP-Ⅳ亦有持續性的抑制作用。體外研究結果顯示,與西格列汀相比,奧格列汀對DPP-Ⅳ的抑制活性更強。奧格列汀的IC50值為1.6 nM,而西格列汀則為18nM。此外,奧格列汀對DPP-Ⅳ的選擇性更高,而對其余蛋白酶如DPP8、FAP和QPP等活性更低。奧格列汀具有半衰期長的特點,其半衰期可達63h,而西格列汀僅12.4h。因此,每周給藥一次的奧格列汀仍可有效控制血糖。
在一項有414例2型糖尿病患者參與的為期24周的臨床試驗中,上述患者被隨機分配接受安慰劑,西格列汀和奧格列汀治療。研究結果顯示,接受每周一次奧格列汀治療的患者與接受安慰劑治療的患者相比,HbA1c比入組時的基線水平大幅度降低(0.66% vs 0.13%,P<0.001)。HbA1c的下降程度與每天服用一次的西格列汀相似(-0.66% vs -0.65%)。此外,奧格列汀還可顯著降低餐后2小時血糖和空腹血糖值。奧格列汀不良反應輕微,主要有鼻咽炎,胃腸道反應和感染等。奧格列汀具有對體重不產生影響,不引起低血糖反應,也不會引起水腫等優勢。
在全球范圍(包括美國、歐洲、加拿大、中國臺灣地區)內,奧格列汀所涉及的Ⅲ期臨床試驗多達10項,共有約8000例2型糖尿病患者參與。默克原計劃于2015年年底向美國FDA提出每周一次的奧格列汀用于治療2型糖尿病的上市申請。與武田公司相比,默克公司對歐美等主流市場表現得更積極。奧格列汀若順利通過美國FDA批準上市,其市場情況不可估量。
| 確保搶占中國糖尿病藥物市場的有力武器-專利戰略
如前文所述,我國現有糖尿病患者1.1億人,且患病率呈逐年增長趨勢。為占領我國降糖藥這一龐大市場,武田公司和默克公司通過專利戰略在中國進行專利布局并申請了系列專利。筆者現對武田公司就琥珀酸曲格列汀和默克公司就奧格列汀在中國申請的核心專利進行調研及解讀,如下文所述。有關原研公司在中國申請的與琥珀酸曲格列汀或奧格列汀相關的專利分別詳見表2和表3。
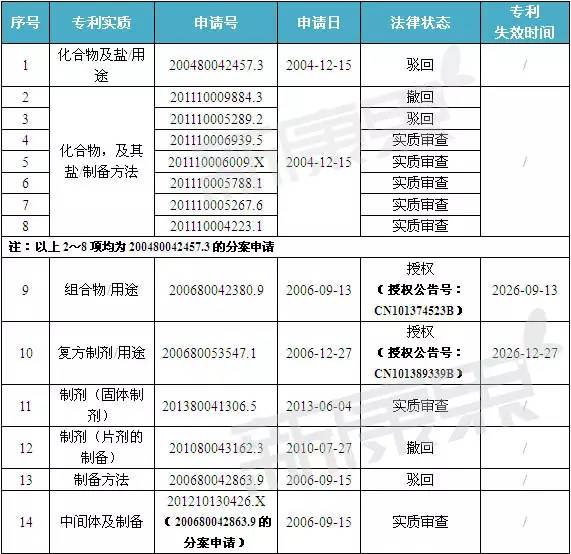
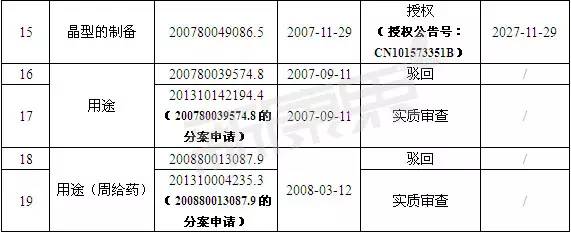
注:數據截止至:2015-12-23
經對表2數據分析可知:武田共在中國申請了19項與曲格列汀相關的專利,目前有3項獲得授權,上述3項授權專利覆蓋了單方制劑,復方制劑(聯合用藥)和晶型的制備。其中,要求保護的琥珀酸曲格列汀A晶型的制備方法的專利CN101573351B將于2027年11月29日到期;要求保護的單方制劑專利CN101374523B將于2026年9月13日到期;要求保護曲格列汀或其鹽與吡格列酮或伏格列波糖聯合用藥的制劑專利CN101389339B則將于2026年12月27日到期。
值得一提的是,首篇包含曲格列汀化合物在內的通式化合物專利200480042457.3在中國已被駁回。在此基礎上,武田公司于2011年先后共申請了7項分案申請,目前有6項處于實質審查階段。其中,201110005788.1要求保護的是曲格列汀的琥珀酸鹽-該鹽正是上市活性成分。該專利若能獲得授權,其專利到期時間為2024年12月15日。需特別說明的是,琥珀酸曲格列汀的A晶型在中國并未獲得保護,專利CN101573351B僅保護A晶型的制備方法。此外,用途專利201310142194.4和201310004235.3均處于實審階段。
由此可見,盡管武田公司從多方位角度對琥珀酸曲格列汀實施專利戰略,但實際上琥珀酸曲格列汀在中國所獲得的保護權益相對較弱。即使化合物專利可獲得授權,其也將于2024年12月15日到期。因此,國內企業對本品的研發集中度高也在情理之中。
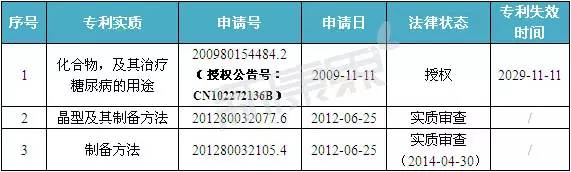
注:數據截止至:2015-12-23
經對表3中數據分析可知:與琥珀酸曲格列汀相比,盡管目前默克公司在中國申請的專利并不多,但與奧格列汀相關的化合物/用途專利CN102272136B已獲得授權,該專利將于2029年11月11日到期。此外,201280032077.6要求保護與奧格列汀相關的4種晶型(晶型I、II、III和IV),若該專利申請在中國獲得授權,其到期時間將為2032年6月25日。201280032105.4要求保護的則是一種制備方法,其法律狀態有待進一步跟進。此外,默克公司還申請了制劑專利WO2015031228A1,該申請指定中國,盡管目前尚未進入國家公開階段。
由此可見,奧格列汀的化合物/用途專利CN102272136B為默克公司搶占中國降糖藥市場提供了有力保障,若其它專利申請獲得授權,從某種意義上說更是延長了本品在中國未來市場的生命線。總之,對國內企業而言,奧格列汀的國產化主要受限于化合物/用途專利CN102272136B。此外,晶型專利201280032077.6對國內企業研發本品也存在一定的風險。
綜上對原研公司就曲格列汀和奧格列汀在中國的專利布局可知,奧格列汀在中國的化合物專利將于2029年11月到期,該專利將限制國內企業短時間內對該產品的仿制。相反,即使曲格列汀的化合物專利再獲得授權,其也將于2024年12月到期。由此可預期曲格列汀將比奧格列汀更早國產化。
| 曲格列汀-國內企業競爭激烈;奧格列汀-原研公司捷足先登
如前文所述,我國現有1.1億糖尿病患者,且患病率呈逐年增高趨勢。DPP-Ⅳ因療效確切,安全性和耐受性良好已成為口服降糖藥中的佼佼者,并已幾乎占領全球降糖藥市場的1/3。長效DPP-Ⅳ抑制劑因每周僅需給藥一次而提高患者給藥的簡便性和依從性更是受到醫學界的高度關注。曲格列汀首獲上市不到一年的時間,國內已有多家企業搶仿。迄今為止,我國CFDA已受理來自不同企業的21個原料藥和39個片劑的注冊申請(詳細信息見表4),預計后續還會有企業提出有關本品的注冊申請。

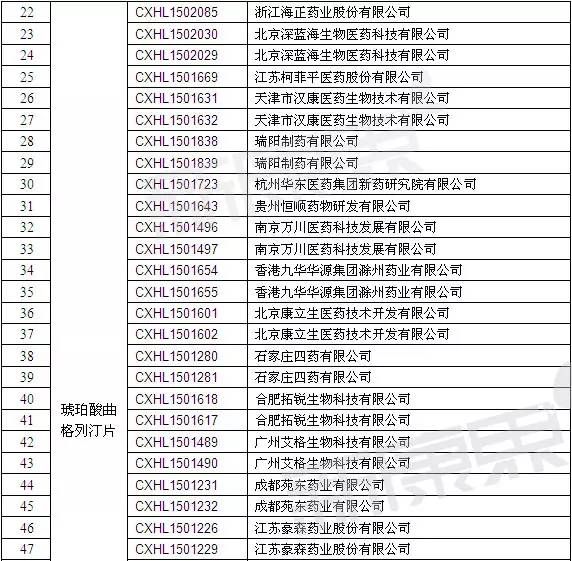
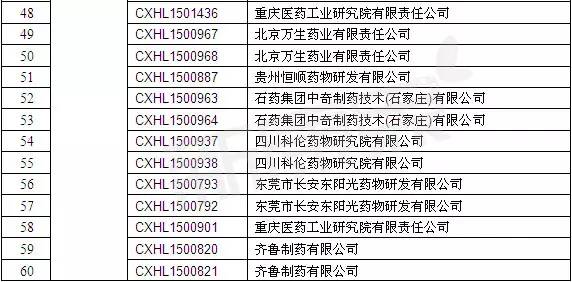
注:數據截止至:2015-12-23
目前,尚未見武田公司向我國CFDA提出有關琥珀酸曲格列汀進口注冊之相關信息。然而,與武田公司不同的是,默克公司早在2014年5月26日就已向我國CFDA提出有關奧格列汀片的注冊申請(受理號:JXHL1400156),現已獲臨床批件。至今,尚未見國內企業向我國CFDA提出有關奧格列汀的注冊申請。盡管如此,但不難看出,與琥珀酸曲格列汀相比,奧格列汀在中國的上市指日可待。
綜上,就現已在日本獲批上市的兩個長效DPP-Ⅳ抑制劑來說,我們可推斷未來幾年中國降糖藥市場將出現琥珀酸曲格列汀以國產產品為主,奧格列汀以原研產品為主的局面。不過,未來各企業的市場表現如何需時間去證實。
信息來源:新康界
|