中藥配方顆粒放開,哪些企業有機會?
日期:2016/1/4
題記
CFDA2015年第283號公告《中藥配方顆粒管理辦法(征求意見稿)》的發布意味著中藥配方顆粒的生產即將放開,咸達數據V3.2將為你解密目前有多少企業符合資格進入中藥配方顆粒市場?
目前只有六家生產企業擁有中藥配方顆粒試點生產企業資質
2001年7月,國家藥監局頒發的《中藥配方顆粒管理暫行規定》將中藥配方顆粒納入中藥飲片管理的范疇。此后,對中藥配方顆粒試點生產企業資質的管控一直處于從嚴管控狀況,全國僅有六家企業獲得這一資質,分別是:
一、江陰天江藥業有限公司,是中國第一家中藥配方顆粒研制生產企業,是國家中醫藥管理局指定首家“全國中藥飲片改革試點單位”,國家藥品監督管理局首批指定的“中藥配方顆粒試點生產企業”,江陰天江藥業有限公司中藥配方顆粒已過2010年版GMP,沒有GAP基地;
二、廣東一方藥業,江陰天江藥業有限公司、廣東一方制藥有限公司宣布合并,廣東一方成為天江藥業的全資子公司,廣東一方制藥有限公司顆粒劑(含中藥配方顆粒劑)已過2010年版GMP,沒有GAP基地;
三、培力(南寧)藥業有限公司,顆粒劑(含中藥配方顆粒)已過2010年版GMP;
四、深圳三九現代中藥有限公司,華潤三九醫藥股份有限公司惠州和深圳的生產地已過中藥配方顆粒2010年版GMP,雅安三九中藥材科技產業化有限公司有三個中藥(附子、麥冬、魚腥草)GAP基地;
五、四川綠色藥業科技發展股份有限公司顆粒劑(中藥配方顆粒)(含中藥前處理提取)已過2010年版GMP,擁有川芎GAP生產基地;
六、.北京康仁堂藥業有限公司顆粒劑(中藥配方顆粒)已過2010年版GMP,沒有GAP基地。
根據《中藥配方顆粒管理辦法(征求意見稿)》,生產中藥配方顆粒的中藥生產企業應當具備以下條件:
(一)在中國境內依法設立,能夠獨立承擔責任(包括具備藥品質量安全責任承擔能力);
(二)已獲得顆粒劑生產范圍,具有中藥飲片炮制、提取、濃縮、干燥、制粒等完整生產能力,符合《藥品生產質量管理規范》(藥品GMP)要求;
(三)設立藥品質量檢驗、管理專門機構及專職人員,制定質量管理規章制度,具備完善的藥品質量保證體系,具備產品放行、召回等質量管理能力;
(四)設立藥品監測與評價專門機構及專職人員,建立藥品監測與評價體系,具備對藥品實施風險管理的能力,依法承擔藥品不良反應監測、風險效益評估、風險控制義務,負責建立并維護藥品不良反應監測系統,對藥品監測與評價進行管理。
咸達數據V3.2對已過2010年版GMP的數據跟蹤發現,目前已有1072家企業獲得顆粒劑的GMP證書,擁有提取的GMP證書有917家企業,同時擁有提取和顆粒劑GMP的生產廠家有628家。吉林省有潛力擴大生產范圍的企業數最多,共67家;廣東有59家排第二;廣西有57家企業,四川有56家,山東有48家,分別位列第3和第5。
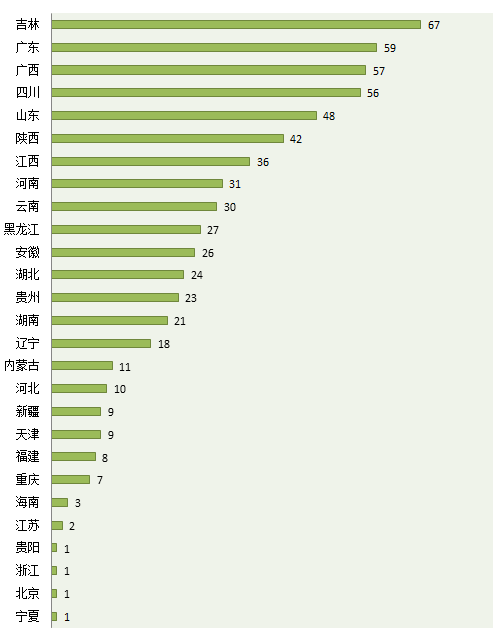
數據來源:咸達數據V3.2
此外,生產企業所用中藥材,凡是能人工種植/養殖的,提倡來源于生產企業按照《中藥材生產質量管理規范》的要求自建或合建的規范化種植/養殖基地,即GAP生產基地。
咸達數據V3.2發現目前共有126個企業擁有GAP基地,只有73個中藥有GAP認證。其中人參是最多企業認證GAP的藥材,其次是丹參,板藍根、金銀花和三七并列第三。鼓勵企業認證GAP是中醫藥“十三五”規劃的重要方向。若政策嚴格要求原料藥材來源必定是過了GAP認證的產品,那么市場上就只有73個中藥配方顆粒,遠遠少于2015年版中國藥典收錄的618個中藥藥材和飲片數。
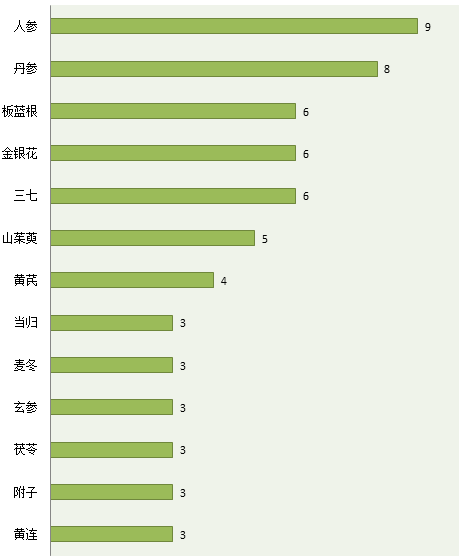
數據來源:咸達數據V3.2
628個企業有資格申請中藥配方顆粒生產范圍,這意味著中藥配方顆粒的生產資質要求比較低。從國家以往的政策看來,國家并不希望一下子就放開審批。那么必會在GAP基地、工藝過程中對藥材特征成分指紋圖譜含量和各種農藥殘留含量的測定會從嚴。GAP認證和質量控制的成本將會制約符合條件的628個企業進入中藥配方顆粒生產的意愿。
信息來源:E藥經理人
|