5藥企被查,震蕩波及84家!
日期:2016/1/6
12月30日,國家食藥監總局接連發布兩則和藥品質量有關通告,不僅僅是相關涉事企業都收到了嚴懲,還有不少企業受到牽連。在2016,藥品質量要求不會降低。
1藥企被查,40家藥企被召回產品
一查到底,追溯到原料!
日前,國家局食藥監總局通報,長治市三寶生化藥業有限公司等4家企業生產的復方肝浸膏片(膠囊)存在鉻超標的問題,12月30日,國家局發布公告稱,調查組現場檢查,查明中檢出的高含量鉻來自于制劑生產所用原料藥枸櫞酸鐵銨,所用枸櫞酸鐵銨為重慶市全新祥盛生物制藥有限公司生產。
國家局要求重慶市食品藥品監督管理局立即收回重慶市全新祥盛生物制藥有限公司枸櫞酸鐵銨的藥品GMP證書,監督企業進一步查清生產銷售情況,召回已上市銷售的有效期內的產品,并對該企業立案調查。
同時經調查發現,重慶市全新祥盛生物制藥有限公司生產的枸櫞酸鐵銨銷往40家藥品生產企業,上述40家藥品生產企業應立即停止使用重慶市全新祥盛生物制藥有限公司生產的枸櫞酸鐵銨生產藥品,并對使用該原料藥用于藥品生產的情況進行排查,查清所有有效期內藥品的品種、批次、銷售流向,召回市場銷售的產品。
必須召回相關產品40家藥企名單:
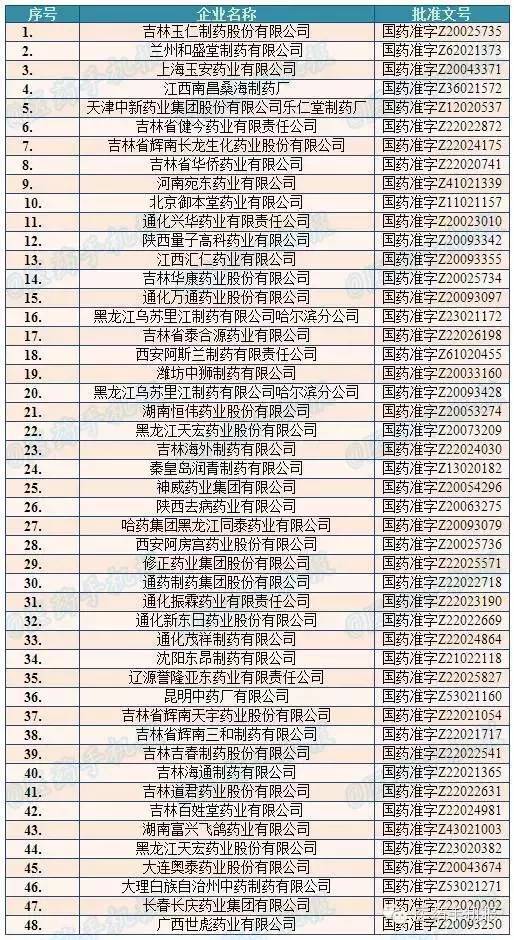
4藥企被查,牽連44家
12月30日,國家食品藥品監督管理總局發布《關于吉林省輝南三和制藥有限公司等企業違法生產精制冠心片的通告》(2015年第109號),稱吉林省輝南三和制藥有限公司、吉林省輝南天宇藥業股份有限公司、吉林吉春制藥股份有限公司、西安阿斯蘭制藥有限責任公司四家企業精制冠心片留樣產品中檢出植物組織,表明上述企業使用丹參、川芎、赤芍、紅花等藥材粉末直接投料,減少藥材提取等關鍵生產步驟,違反注冊申報工藝生產藥品。
國家局表示,使用藥材粉末直接投料、減少藥材提取步驟,均可能會影響藥品質量和療效。上述四家企業的行為違反《中華人民共和國藥品管理法》等有關規定,陜西省食品藥品監督管理局已對西安阿斯蘭制藥有限責任公司立案調查,依法收回其藥品GMP證書,吉林省食品藥品監督管理局正在調查處理中。總局要求所有經營、使用單位立即停止銷售、使用上述四家企業的精制冠心片。
此外,國家局還要求所有精制冠心片生產企業立即開展自查,凡存在違反生產工藝,使用藥材粉末直接投料,減少藥材提取等關鍵生產步驟的,應立即停止違法生產行為,召回已銷售的產品。自查情況于2016年1月20日前報告國家食品藥品監督管理總局。國家食品藥品監督管理總局將繼續組織對市場銷售的此類制劑加強檢查和檢驗,一旦發現生產企業存在上述違法行為,將依法嚴肅查處。
國家食藥監局的官方網站顯示,共有48家企業擁有精制冠心片的生產批文,除去4家被國家局通報的企業,還有44家藥企被波及,要開展自查了。
信息來源:賽柏藍
|