【新格局】數據說話:中藥行業洗牌在即,會有多少"剩者"/"勝者"?
日期:2016/1/14
剛剛過去的2015年的年末,CFDA連續發了2個關于中藥行業的公告:一是有關中藥配方顆粒放開,二是關于中藥提取和提取物的規定。本文將從中藥企業數據層面分析目前中藥行業的生產現狀。
2016年,中藥行業洗牌在即。新格局將變成怎樣?會有多少“剩者”/“勝者”?
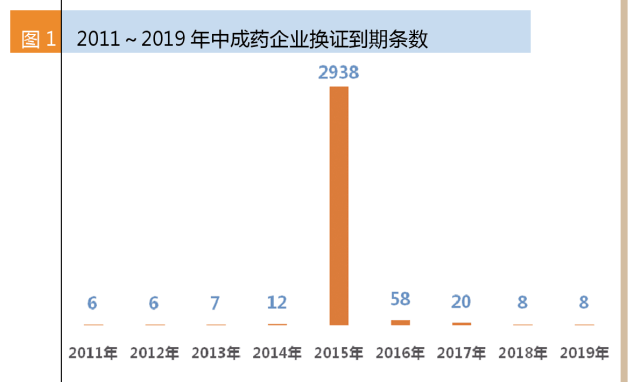
咸達數據V3.2監測藥品生產企業分類碼含“Z”(即中成藥)的數據共3065條,其中2015年到期的有2938條,占總數據的95.8%。這意味著2016年是許多中藥企業換證的年限,2010年版GMP對中藥企業的沖擊結果將在今年塵埃落定。
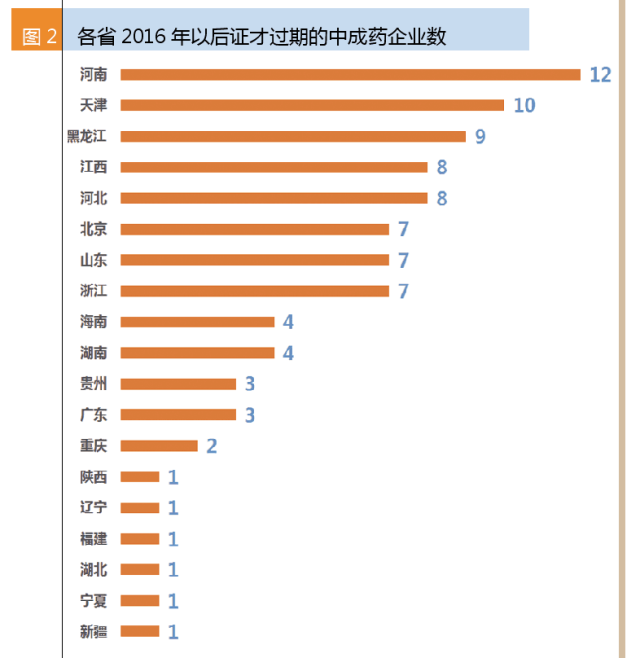
2016~2019年才過期的90家中成藥生產企業中,河南的企業最多,共12家;其次是天津,共10家;第三是黑龍江。一些中藥企業較多的省份都是2015年到期,如吉林、廣西和四川。即使是有著中成藥傳統的廣東,2016年后才過期的只有3家。
根據2015年12月31日發布的《食品藥品監管總局公告要求落實中藥提取和提取物監督管理有關規定》要求,自2016年1月1日起,凡不具備相應提取能力的中成藥企業必須停產。
筆者數據分析發現,分類碼含“Z”的3065家中成藥生產企業中,生產范圍包括“提取”的有1369家,其中2016年后過期的企業僅43家。國內上市藥品批文對應的中成藥生產廠家共3000家,擁有“提取”的GMP企業只有917家。根據《食品藥品監管總局關于加強中藥生產中提取和提取物監督管理的通知》(食藥監藥化監〔2014〕135號),“集團內部具有控股關系的藥品生產企業可共用前處理和提取車間”,因而實際上,917家GMP對應的企業將多于917家。但是缺口仍太大,預計中成藥生產廠家或許要被淘汰三分之二。
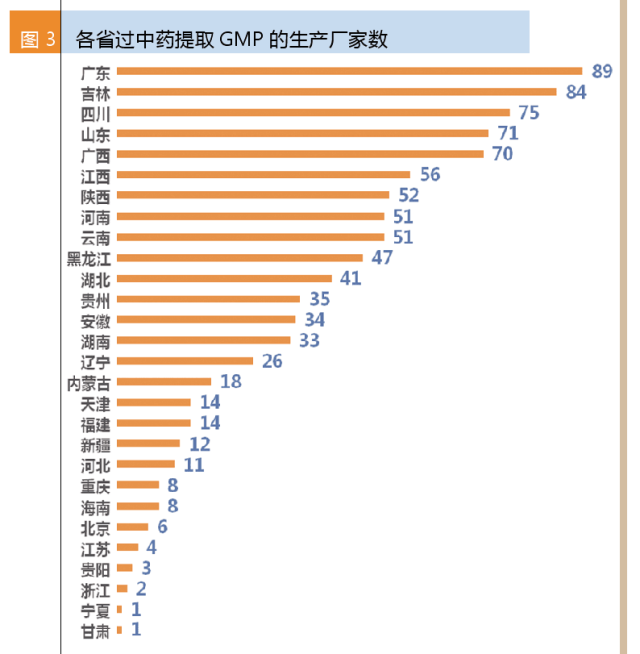
各省過中藥提取的GMP數據中:廣東廠家數最多,共89家;其次是吉林,共84家;四川、山東和廣西的廠家數都過70家。值得注意的是,華東過中藥提取GMP的廠家數并不多,浙江才2家,江蘇4家,上海0家。
按照《食品藥品監管總局關于切實做好實施藥品生產質量管理規范有關工作的通知》(食藥監藥化監〔2015〕277號),“2016年1月1日起,各省(區、市)食品藥品監督管理局負責所有藥品GMP認證工作。對于通過認證的企業,由各省(區、市)食品藥品監督管理局核發《藥品GMP證書》;對于未通過認證的企業,也應公布現場檢查發現的嚴重缺陷項目、主要缺陷項目”。
因此,目前未通過中藥提取的生產企業有可能在省局考核下通過認證,但CFDA的飛行檢查以中藥飲片和中成藥生產企業居多。其中,中成藥生產企業被取消GMP的原因主要是“前提取處理車間已不具備GMP生產條件,如部分設備表面銹蝕、濃縮間墻壁發黑發霉嚴重等”“偽造批生產記錄,生產管理混亂”。《2015年全國收回藥品GMP證書情況統計》顯示,2015年CFDA收回藥品GMP數量150個,預計2016年飛行模式會成為CFDA管理GMP的常態模式。
對中藥配方顆粒生產資質的管控一直處于從嚴狀況。
2001年7月,《中藥配方顆粒管理暫行規定》將中藥配方顆粒納入中藥飲片管理的范疇。在2015年12月24日《中藥配方顆粒管理辦法(征求意見稿)》發布以前,全國僅有6家企業獲得中藥配方顆粒試點生產企業資質,分別是:江陰天江藥業有限公司、廣東一方制藥有限公司(天江藥業的全資子公司)、培力(南寧)藥業有限公司、深圳三九現代中藥有限公司、四川綠色藥業科技發展股份有限公司和北京康仁堂藥業有限公司顆粒劑。此6家企業都已過中藥配方顆粒的2010年版GMP。
根據《中藥配方顆粒管理辦法(征求意見稿)》,“所用中藥材,凡是能人工種植/養殖的,提倡來源于生產企業按照《中藥材生產質量管理規范》的要求自建或合建的規范化種植/養殖基地,即GAP生產基地”。而這6家企業只有2家(含集團公司)有GAP基地:雅安三九中藥材科技產業化有限公司有3個(附子、麥冬、魚腥草)GAP基地,四川綠色藥業科技發展股份有限公司擁有川芎GAP基地。
《中藥配方顆粒管理辦法(征求意見稿)》要求生產中藥配方顆粒的企業必須已獲得顆粒劑生產范圍,具有中藥飲片炮制、提取、濃縮、干燥、制粒等完整生產能力,符合藥品GMP要求。這意味著中成藥生產企業要想在生產范圍增加中藥配方顆粒,必須擁有“顆粒劑”和“中藥提取”GMP證書。
咸達數據V3.2分析發現,生產范圍是顆粒劑的中成藥生產企業有2052家,其中2015年過期的有1989家。已有1072家企業獲得顆粒劑的2010年版GMP證書,擁有提取的GMP證書有917家企業,同時擁有提取和顆粒劑GMP的生產廠家有628家。
根據《食品藥品監管總局公告要求落實中藥提取和提取物監督管理有關規定》,“自2016年1月1日起,生產使用中藥提取物必須備案。自2016年1月1日起,對中成藥國家藥品標準處方項下載明,且具有單獨國家藥品標準的中藥提取物實施備案管理”。
筆者查詢《國家中成藥標準匯編》發現,所謂的處方項就是藥品組方及含量。2014年7月29日發布的《中藥提取物備案管理實施細則》描述:中藥提取物是中成藥國家藥品標準的處方項下載明,并具有單獨國家藥品標準,且用于中成藥投料生產的揮發油、油脂、浸膏、流浸膏、干浸膏、有效成份、有效部位等成份。中藥提取物不包括:中成藥國家藥品標準中附有具體制法或標準的提取物;按新藥批準的中藥有效成份或有效部位;冰片、青黛、阿膠等傳統按中藥材或中藥飲片使用的產品;鹽酸小檗堿等按化學原料藥管理,并經過化學修飾的產品。
國產藥品的中藥批文共60,600個,對應10,900個產品名。目前中成藥國家藥品標準中,揮發油對應的產品共有9個產品,浸膏或流浸膏或干浸膏的有419個,提取物的有128個。
由于納入國家標準中的產品通常只是用藥途徑的其中一個或兩個劑型,但該組方的其它劑型應該也需要備案。比如,口服藥的片劑進國家標準了,同組方的膠囊、合劑等口服劑型雖然未入標準但同樣需要做備案。有鑒于此,實際需要備案的產品名應不僅限于上述所言的數量。
截至2016年1月1日,咸達數據V3.2監測CFDA的“中藥提取物備案公示”數據發現,目前只有418個中藥批文有備案,對應209個產品名。中藥注射液共有37個產品批文做了中藥提取物備案,對應8個產品名,分別為銀杏達莫注射液、清開靈注射液、燈盞花素注射液、血塞通注射液、舒血寧注射液、燈盞花素氯化鈉注射液、注射用燈盞花素和血栓通注射液。在中成藥國家藥品標準中,中藥注射液中組方有“提取物”的有膽木注射液、巖黃連注射液、舒肝寧注射液、夏天無注射液、茵梔黃注射液、銀黃注射液;有“浸膏”的有消癌平注射液和心脈隆注射液。由此可見,沒有進入國家標準但仍要做提取物備案的還有不少產品。
目前有229個企業做了中藥提取物備案。天津中新藥業集團股份有限公司達仁堂制藥廠是備案最多的企業,共15個產品批文備案;云南白藥集團股份有限公司、云南維和藥業股份有限公司、北京同仁堂科技發展股份有限公司制藥廠、廣西邦琪藥業集團有限公司和廣西玉林制藥集團有限責任公司并列第二,各有10個產品批文備案。
不知道是數據庫的統計滯后,還是中藥生產企業對政策到期日期并不敏感,從目前過中藥提取的GMP和已備案到中藥提取物數據等來看,中成藥生產企業在2016年開端就要面臨生產資質的挑戰。現有的數據顯示,中成藥生產企業的幸存率并不高,3000家企業有可能壓縮到1000家左右。
即便是中藥配方顆粒的機會,也是為幸存者擁有。此機會伴之而來的有GAP基地認證、與湯劑一致的臨床效果要求、指紋圖譜和農殘重金屬的質量控制所帶來的高成本與終端價格偏低的矛盾。
2016年,中藥行業洗牌在即,許多中成藥企業期望在2016年12月31日前即《關于加快實施新修訂藥品生產質量管理規范促進醫藥產業升級有關問題的通知》(國食藥監安〔2012〕376號)政策鼓勵的時間關口前被收購。然而,現在市場上有如此愿望的中成藥企業不在少數,而買家數量是有限的,此類企業或許要考慮——除了被收購之外的其它機會,或尋求融資,或抱團取暖重新上路。
信息來源:醫藥經濟報
|