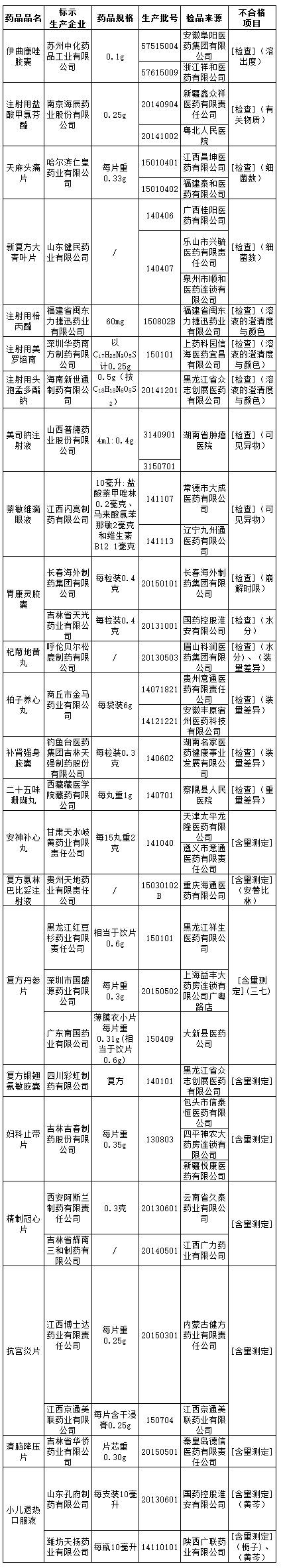
在2016年第54號通告中,29家藥企生產的伊曲康唑膠囊等36批次藥品經檢驗為不合格產品;在2016年第53號通告中,4家藥企生產的13批次藥品經檢驗不合格;在2016年第52號通告中,9家藥企存在嚴重違法違規生產婦科止帶片的行為;在2016年第51號通告中,8家藥企存在嚴重違法違規生產胃康靈膠囊行為。
★涉事藥企名單:
-
蘇州中化藥品工業有限公司
-
南京海辰藥業股份有限公司
-
哈爾濱仁皇藥業有限公司
-
山東健民藥業有限公司
-
福建省閩東力捷迅藥業有限公司
-
深圳華藥南方制藥有限公司
-
海南新世通制藥有限公司
-
山西普德藥業股份有限公司
-
江西閃亮制藥有限公司
-
長春海外制藥集團有限公司
-
吉林省天光藥業有限公司
-
呼倫貝爾松鹿制藥有限公司
-
商丘市金馬藥業有限公司
-
釣魚臺醫藥集團吉林天強制藥股份有限公司
-
西藏藏醫學院藏藥有限公司
-
甘肅天水岐黃藥業有限責任公司
-
貴州天地藥業有限責任公司
-
黑龍江紅豆杉藥業有限責任公司
-
深圳市國盛源藥業有限公司
-
廣東南國藥業有限公司
-
四川彩虹制藥有限公司
-
吉林吉春制藥股份有限公司
-
西安阿斯蘭制藥有限責任公司
-
吉林省輝南三和制藥有限公司
-
江西博士達藥業有限責任公司
-
江西京通美聯藥業有限公司
-
吉林省華僑藥業有限公司
-
山東孔府制藥有限公司
-
濰坊天揚藥業有限公司
★不合格藥品:23個品種36批次
不合格項目包括溶出度、有關物質、細菌數、溶液的澄清度與顏色、可見異物、崩解時限、水分、裝量差異、重量差異和含量測定等。
36批次不合格藥品名單
★處理結果:
對上述不合格藥品,山西、內蒙古等16省(區)藥監局已采取要求企業暫停生產銷售、立即召回產品等措施。國家藥監總局要求有關省(區)藥監局責令相關企業認真查找原因,并根據情況立案調查,依法處理。查處情況于2016年5月31日前向社會公布,并報國家總局。
★涉事藥企名單:
①湖南恒生制藥股份有限公司
②南京制藥廠有限公司
③四川德元藥業集團有限公司
④吉林白山正茂藥業股份有限公司
★不合格藥品:3個品種13批次
●湖南恒生制藥股份有限公司生產的注射用輔酶A
●南京制藥廠有限公司生產的順鉑注射液
●四川德元藥業集團有限公司和吉林白山正茂藥業股份有限公司生產的小兒咳喘靈顆粒
13批次不合格藥品名單

★處理結果:4家藥企被責令整改,整改到位前不得恢復生產
對上述不合格藥品,吉林、江蘇、湖南、四川省藥監局已采取要求企業暫停生產銷售、立即召回產品等措施。
湖南恒生制藥股份有限公司、南京制藥廠有限公司、四川德元藥業集團有限公司和吉林白山正茂藥業股份有限公司多批次產品不合格,反映該4家企業在質量管理方面存在問題。國家藥監總局要求吉林、江蘇、湖南、四川省食品藥品監督管理局責令上述企業徹查藥品質量問題原因,并采取有針對性的措施進行整改,整改到位前不得恢復生產;對上述企業依據《中華人民共和國藥品管理法》相關規定查處。查處情況于2016年5月31日前向社會公布,并報總局。
★涉事藥企名單:
①吉林百琦藥業有限公司
②吉林吉春制藥股份有限公司
③吉林天光藥業有限公司
④通化金馬藥業集團股份有限公司
⑤通化斯威藥業股份有限公司
⑥通化振霖藥業有限責任公司
⑦安徽同泰藥業有限公司
⑧江西民濟藥業有限公司
⑨貴州浩誠藥業有限公司
★違規生產藥品:婦科止帶片
★違法違規行為:經湖南省食品藥品檢驗研究院檢驗,發現上述9家企業生產的部分批次婦科止帶片檢出椿皮、黃柏、五味子或山藥等藥材原粉的顯微特征,提示企業可能存在違反生產工藝要求,使用藥材原粉替代提取物投料的情況。
★處理結果:5家藥企被收回GMP證書
吉林、安徽、貴州省藥監局分別查明8家企業存在違反注冊申報工藝,使用藥材原粉替代提取物投料的行為,具體情況分別為:吉林百琦藥業有限公司使用黃柏、椿皮、五味子藥材原粉投料;吉林吉春制藥股份有限公司使用黃柏藥材原粉投料;吉林天光藥業有限公司使用黃柏、椿皮藥材原粉投料;通化金馬藥業集團股份有限公司使用椿皮、五味子藥材原粉投料;通化斯威藥業股份有限公司使用山藥、黃柏、五味子藥材原粉投料;通化振霖藥業有限責任公司使用五味子藥材原粉投料;安徽同泰藥業有限公司使用黃柏、五味子藥材原粉投料;貴州浩誠藥業有限公司使用黃柏藥材原粉投料。
相關省食品藥品監督管理部門已采取要求企業立即暫停生產銷售、召回產品的措施,以控制風險。吉林省藥監局依法收回了吉林百琦藥業有限公司、吉林吉春制藥股份有限公司、吉林天光藥業有限公司、通化斯威藥業股份有限公司和通化振霖藥業有限責任公司共5家企業的藥品GMP證書。通化金馬藥業集團股份有限公司原生產婦科止帶片的舊廠區(車間生產設備已拆除)藥品GMP證書已過期,未在原址重新認證。
國家藥監總局要求江西省藥監局盡快對江西民濟藥業有限公司婦科止帶片生產情況進一步調查核實,相關情況于2016年3月31日前報告總局。
吉林、安徽、江西、貴州省統計局要對企業違法行為進行立案調查,在控制風險的同時,迅速查清違法事實,按《中華人民共和國藥品管理法》相關規定查處。查處情況于2016年5月31日前向社會公布,并報總局。
★涉事藥企名單:
●河北國金藥業有限責任公司
●吉林吉春制藥股份有限公司
●吉林省華威藥業有限公司
●上海皇象鐵力藍天制藥有限公司、
●海南海神同洲制藥有限公司
●陜西秦龍濟康藥業有限責任公司
●陜西去病藥業有限公司
★違規生產藥品:胃康靈膠囊
★違法違規行為:經廈門市藥品質量檢驗研究院檢驗,發現上述8家企業生產的部分批次胃康靈膠囊中檢出白芍藥材原粉的顯微特征,提示企業可能存在違反生產工藝要求,使用白芍藥材原粉替代白芍提取物投料的情況。
★處理結果:3家藥企被收回GMP證書
河北、吉林、黑龍江省藥監局分別查明河北省的國金藥業有限責任公司,吉林省華威藥業有限公司、吉林吉春制藥股份有限公司和黑龍江省的上海皇象鐵力藍天制藥有限公司等5家企業存在違反注冊申報工藝,使用白芍藥材原粉投料的行為。相關省食品藥品監督管理部門已采取要求企業立即召回產品、暫停生產銷售的措施,以控制風險。吉林省藥監局已依法收回吉林省華威藥業有限公司和吉林吉春制藥股份有限公司等3家企業的藥品GMP證書。
國家藥監總局要求海南、陜西省藥監局盡快對海南海神同洲制藥有限公司、陜西秦龍濟康藥業有限責任公司和陜西去病藥業有限公司3家企業胃康靈膠囊生產情況進行調查核實,相關情況于2016年3月31日前報告總局。
河北、吉林、黑龍江、海南、陜西省藥監局要對企業違法行為進行立案調查,在控制風險的同時,迅速查清違法事實,按《中華人民共和國藥品管理法》相關規定查處。查處情況于2016年5月31日前向社會公布,并報總局。
信息來源:醫藥觀察家網