1月27日,深圳微芯生物科技公司在市政府新聞發布廳舉行原創新藥、國家863及“重大新藥創制”專項成果西達本胺新聞發布會。西達本胺是全球首個獲準上市的亞型選擇性組蛋白去乙酰化酶口服抑制劑,也是中國首個授權美國等發達國家專利使用的原創新藥。
此舉將填補我國T細胞淋巴瘤治療藥物的空白,也標志著我國基于結構的分子設計、靶點研究、安全評價、臨床開發到實現產業化全過程的整合核心技術與能力得以顯著提升,是我國醫藥行業的歷史性突破。
中國首個授權美國等發達國家專利使用的原創新藥

微芯生物總裁兼首席科學官魯先平
西達本胺(Chidamide,商品名愛譜沙/epidaza)屬于全新作用機制的綜合靶向抗腫瘤靶向藥物,其首個適應癥為復發及難治性外周T細胞淋巴瘤,前期臨床結果顯示,患者臨床獲益率近50%,生存期明顯延長。
據微芯生物總裁兼首席科學官魯先平介紹,西達本胺的新機制專門針對轉移復發和免疫逃逸,將會用于多種類型的腫瘤,目前乳腺癌和肺癌研究都已進入三期臨床。未來西達本胺將會是有效幫助患者克服耐藥性、復發和轉移的重要手段。
西達本胺針對首個適應癥復發及難治性外周T細胞淋巴瘤的新藥申請已獲得國家食品藥品監督管理總局(CFDA)批準,并完成藥品生產質量管理規范認證,首批產品最快今年三月初上市。此外,微芯生物已授權美國、日本、臺灣等國家和地區同步開展單藥及聯合其他抗腫瘤藥物針對其他血液腫瘤、非小細胞肺癌及乳腺癌等實體瘤的臨床研究。
魯先平在接受采訪時說:“該領域,近幾年才出現兩三個新藥,治療費用分別相當于每月28萬人民幣和14萬人民幣。西達本胺在臨床有效性、安全性以及使用方便性上均優于其它產品,并且在價格上只有相關產品的十分之一。”
西達本胺作用機制
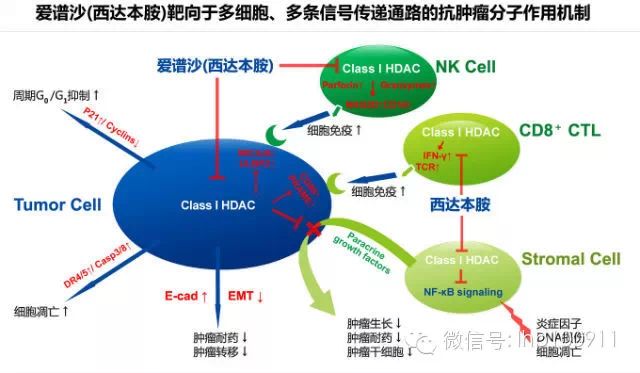
外周T細胞淋巴瘤(PTCL)是一組異質性很強的淋巴細胞異常增殖性疾病,包括約18種病理亞型。PTCL在中國的年發病人數約為6萬人,年患病率約90/百萬,可歸屬于罕見病范疇。
組蛋白去乙酰化酶(HDAC)為表觀遺傳調控重要酶家族,通過開發HDAC抑制劑,可在染色質結構水平上對腫瘤起到治療效果。西達本胺是一個中國原創的新型口服亞型選擇性HDAC抑制劑,對HDAC1、2、3、10亞型具有選擇性抑制作用。
西達本胺通過對特定HDAC亞型的抑制及由此產生的染色質重構與基因轉錄調控作用(即表觀遺傳調控作用),抑制淋巴及血液腫瘤的細胞周期并誘導腫瘤細胞凋亡;誘導和增強自然殺傷細胞(NK)和抗原特異性細胞毒T細胞(CTL)介導的腫瘤殺傷作用及抑制腫瘤病理組織的炎癥反應,不僅能直接貢獻于對T淋巴瘤中循環腫瘤細胞及局部病灶產生療效作用,同時也可能應用于誘導和增強針對其他類型腫瘤的抗腫瘤細胞免疫的整體調節活性。
FDA批準3種藥物
普拉曲沙(pralatrexate)
FDA于2009年和2011年分別批準了兩個以PTCL為適應證的新藥上市,普拉曲沙(pralatrexate)和羅米地辛(Istodax),雖然具有一定療效,但安全耐受性仍然較差。
此外,在2014年7 月 3 日,美國 FDA 批準 Beleodaq (belinostat) 用于PTCL 患者治療。Beleodaq 通過阻止有助于 T 細胞發生癌變的酶起作用。這款藥物適用于治療后(復發性)疾病又卷土重來或對以前治療無效(難治性)的患者。
Beleodaq 的安全性及有效性在一項由 129 名復發或難治性 PTCL 受試者參與的臨床研究中得到評價。所有受試者均以 Beleodaq 治療,直到他們的疾病發生惡化或副作用變得不可接受。結果顯示,25.8% 受試者的癌癥在治療后消失(完全緩解)或縮小(部分緩解)。
Beleodaq 與普拉曲沙由 Spectrum 制藥上市銷售。Istodax 由塞爾基因上市銷售。不過這三款產品都是靜脈注射,西達本胺為口服用藥,具有更方便的臨床服藥方式和更好依從性。
我國原創藥發展的新希望

國家“重大新藥創制”科技專項技術副總師陳凱先
盡管我國是全球第一大制劑藥和第二大原料藥產國,但是98%的產品屬于發達國家專利過期的仿制藥。而真正具有自主知識產權的創新藥絕無僅有。而我國老百姓要使用專利未過期的創新藥,基本依賴進口,但是價格昂貴非一般人能夠承受。
國家“重大新藥創制”科技專項技術副總師陳凱先表示,深圳是我國生物醫藥的發展中非常重要的城市,從過去跟隨國外研發的防治者、跟跑者逐漸向并跑者的方向發展,并在某些方面走到國際引領的位置。
關于深圳微芯
深圳微芯生物由留美歸國博士團隊創立于2001年,專長于原創小分子藥物研發。在腫瘤、糖尿病/代謝疾病、免疫性疾病領域建立了多個從實驗室到臨床及產業化階段的原創新藥產品線。目前,微芯生物已申請67項化合物全球發明專利,其中36項已獲授權。
信息來源:朗信醫藥信息