首張MAH營業執照在上海亮相,花落安必生
日期:2018/10/22
10月9日上午,上海市徐匯區為上海安必生制藥技術有限公司(以下簡稱安必生)頒發了全市首張藥品研發企業上市許可人營業執照。
安必生是2007年注冊在徐匯的一家藥品研發企業,主要從事生物、化學、醫藥專業領域內的技術開發、技術轉讓、技術咨詢、技術服務。
作為國家首批藥品上市許可人持有制度試點企業,其研發的孟魯司特鈉咀嚼片(4mg、5mg)和孟魯司特鈉片(10mg)是全市第一批藥品上市許可持有人制度改革試點公示品種,主要用于治療和預防兒童和成人哮喘,是國內第一個通過仿制藥一致性評價的同類品種。
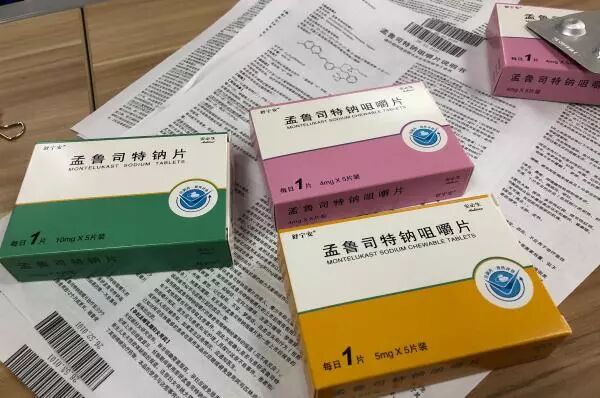
▲“安必生”生產的哮喘治療防治藥物
獲得藥品上市許可持有人資質后,安必生準備自行銷售其研發的上述藥物時,卻碰到了一道無法跨過去的“門檻”。因為安必生營業執照無“藥品生產”的經營范圍,按照稅務部門的相關規定,企業要開具藥品銷售發票,必須先行辦理經營范圍變更手續。
但根據國家的現行法律法規,申請藥品生產許可證,必須具備生產廠房、設備等一系列生產條件,而這些要素,該公司都沒有。
今年的大調研活動中,徐匯區市場監管局副局長高吾名帶隊到安必生走訪時,企業無奈地向市場監管部門“求助”。
對企業提出的問題,區市監局梳理分析后,發現堵點有2個:第一,藥品上市許可持有人是否可以自行銷售其持有的藥品;第二,如果可以銷售,那營業執照上應該增加什么經營范圍?需要前置許可嗎?就上述問題,區市監局第一時間向市食藥監局請示。
對此,市食藥監副局長陳堯水多次召集市局相關處室和徐匯區市場監管局進行專題研討,最終認為:根據原國家食藥監總局《總局關于推進藥品上市許可持有人制度試點工作有關事項的通知》中的“持有人負責藥品生產銷售全鏈條和藥品全生命周期管理,對藥品臨床前研究、臨床試驗、生產制造、經銷配送、不良反應監測等承擔全部法律責任”條款,藥品研發企業成為藥品上市許可持有人后,可以自行銷售所持有的藥品。
第一個難題,通過市區聯動,得到圓滿解決。一切就緒,只欠營業執照這個“東風”。
上海市藥監局就營業執照經營范圍變更這一事宜,主動與市工商局對接,經多次會商達成一致。9月27日,兩部門聯合印發了《關于藥品上市許可持有人銷售所持有藥品資質問題的通知》,明確“持有人可以憑《藥品注冊批件》或《藥品補充申請批件》,向工商(市場)部門申請變更登記增加經營范圍,表述如下:‘藥品委托生產(詳見藥品上市許可持有人藥品注冊批件)’。”第二個難題迎刃而解。
得知這一消息后,安必生于10月8日一早就向徐匯區市場監管局提出了營業執照變更申請。經核查,該申請材料齊全、符合法定形式,徐匯區市場監管局開通綠色通道,當天予以核準。

▲頒證現場
MAH制度將推動CRO、CMO、CSO三大醫藥外包服務模式蓬勃發展
上市許可持有人(MAH)制度最大的意義在于讓醫藥市場要素靈活的流動,不具備藥品經營生產和經營資質的機構和個人只要有創新能力,都可以持有藥品批件,通過委托授權其他生產企業生產或銷售經營企業來進行銷售,而不是過去將批文綁定在生產企業,這也促進了醫藥服務外包的三種形式:上游發研發外包CRO、生產外包CMO、營銷外包CSO。
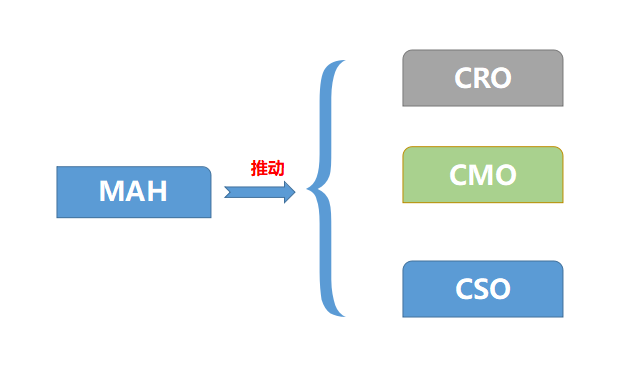 這三種模式不僅僅是政策的推動,同時也是市場到了一定的階段自然產生的分工結果。CRO和CMO實際上也獲得了業界的認可,比如CRO,像藥明康德、泰格,這些CRO為起點,不斷探索醫藥商業模式的企業,無論是在鼓勵新藥創新、一致性評價的大環境下,還是MAH制度帶來的機會中,都獲得了廣闊的發展空間。 這三種模式不僅僅是政策的推動,同時也是市場到了一定的階段自然產生的分工結果。CRO和CMO實際上也獲得了業界的認可,比如CRO,像藥明康德、泰格,這些CRO為起點,不斷探索醫藥商業模式的企業,無論是在鼓勵新藥創新、一致性評價的大環境下,還是MAH制度帶來的機會中,都獲得了廣闊的發展空間。
CMO也是一樣,承接其他MAH的藥品生產,還有界于CMO和CRO之間的CDMO研發定制生產,都是外包的形式。
CSO目前還存在一些爭議,其實它本質上也是一種市場專業化分工形成的一種醫藥外包服務。
由于藥企之間的資源分布不均勻,有些可能生產能力強、工藝先進,那么它就專注于生產;有些銷售能力較弱的,或是在某個領域里推廣能力較弱的,它就把這個品種委托給這個領域里面推廣能力較強的工業企業的銷售團隊。
這是一種資源的重新配置和整合下的商業模式探索和演進,可能未來已經無法嚴格區分某一家企業究竟是生產企業還是CRO、CMO、VC抑或CSO,所以說包括CSO本身在內的外包形式是一種正常的、合乎邏輯和市場規律的一種商業模式。這就MAH制度帶來的第一個歷史性機遇。
信息來源:醫藥云端工作室 |