纈沙坦事件又擴大!所有沙坦藥遭審查
日期:2018/10/22
來源:賽柏藍 整理:小婉
在印度兩制藥企業查出NDEA后,歐盟將審查范圍擴大至所有沙坦類藥物及其原料藥
▍兩家印度藥企查出雜質,歐盟審查升級
近日,歐洲藥品管理局(EMA)更新了華海纈沙坦事件的進展:除中國的華海外,印度的兩家藥企Hetero Labs和Aurobindo Pharma 生產的氯沙坦和厄貝沙坦藥物中,均發現了NDEA(N-亞硝基二乙胺)雜質,因此,歐盟將審查范圍擴展至所有沙坦類藥物。

公告中顯示,歐盟當局正在加強對中國公司浙江華海的監管,并禁止在歐盟藥品中使用其纈沙坦。
時間線顯示,歐盟對藥物的排查范圍在不斷擴大。
2018年7月,對華海藥業纈沙坦的雜質監測(NDMA、NDEA)導致歐盟范圍內對所有纈沙坦藥物的審查。
隨即,EMA通報,在印度藥企Hetero Labs生產的氯沙坦原料藥中,發現了含量極低的NDEA。、
之后,EMA在另一家印度公司Aurobindo Pharma制造的第三種沙坦——厄貝沙坦中也發現了低水平的NDEA。 2018年10月8日,歐洲藥品和醫療保健質量管理局(EDQM)暫停了Aurobindo Pharma的CEP1,有效地阻止了該公司向歐盟供應含有厄貝沙坦的藥物。
上述檢查結果,使歐洲委員會的審查范圍擴大至纈沙坦、坎地沙坦、厄貝沙坦、氯沙坦和奧美沙坦藥物。它們屬于一類被稱為血管緊張素-II-受體拮抗劑(也稱為沙坦)的藥物,用于治療高血壓和心力衰竭的患者。
公告最后,EMA表示將對所有制藥公司進入歐洲的沙坦類原料藥進行檢測。
印度兩家大型制藥企業也相繼查出雜質,表明行業內部確實缺乏相應的檢測標準。不得不說,華海此次自檢,主動報告的行為,使雜質問題進入有關部門的視線之內,加強其日常監管,一定程度上促進了行業檢測水平的提升。
▍歐盟,我國醫藥出口的主要市場之一
據藥素網數據,全球“沙坦類”藥物市場品種總份額比例,已經占到了抗高血壓藥品整體的 30% 以上,由下圖可以看出,纈沙坦、坎地沙坦和厄貝沙坦位居前三位,占整個沙坦類藥物份額的 59.56%。
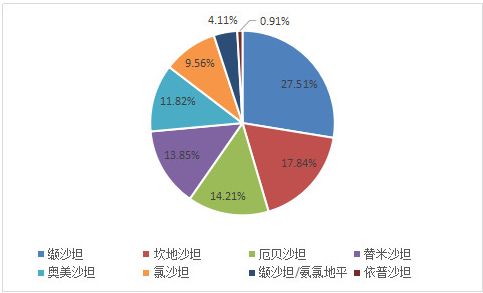
(圖片來源:藥素網)
其中,纈沙坦、坎地沙坦、厄貝沙坦、氯沙坦和奧美沙坦共占據沙坦類藥物近81%的市場份額。
由此可得,歐盟未來納入審查范圍的沙坦類藥物,將是個較龐大的數字。
那歐盟此次擴大核查范圍對我國影響有多大?
藥素網數據顯示,纈沙坦及相關中間體2016年出口額達到了7000多萬美金,換算人民幣5個億,其他各產品也都邁入了過“億”人民幣的行列。全部沙坦出口金額達到了2.8億美元。
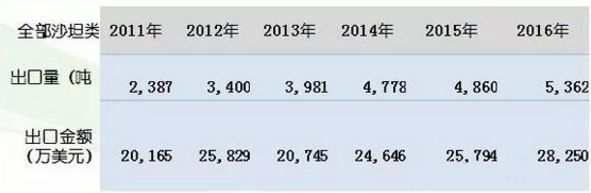
(圖片來源:藥素網)
除此之外,EMA表示將對進入歐洲的沙坦類原料藥進行檢測,而我國是個原料藥生產大國。
眾所周知,原料藥處于醫藥產業鏈的上游,是保障下游制劑、滿足臨床用藥需求的基礎。據中國醫藥保健品進出口商會數據顯示,截至目前,我國原料藥生產企業有2000多家,可生產原料藥約1600種,年產量達100多萬噸。
在有效滿足國內需求的同時,我國原料藥大量銷往國際市場,是在國際競爭中具有一定優勢的行業。今年,我國對歐盟醫藥貿易大幅增長,一季度對歐盟醫藥出口48.9億美元,同比增長26.3%,高于美國、日本、印度等主要醫藥市場。
資料顯示,華海藥業一直是沙坦類原料的全球領頭,浙江天宇藥業排行老二。
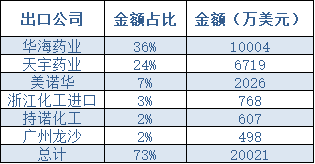
此次事件,華海藥業2018年受影響部分銷售總額占公司2017年度總銷售額的11.24%,2018年1-8月,受影響部分銷售額占相應月份總銷售額的13.04%,涉及約4.3億元人民幣。
也許,歐盟擴大審查范圍,國內受到影響的藥企也會變得更多。
|