分級管理后,抗腫瘤藥競爭格局要變
日期:2018/10/23
【云端導讀】
國家衛健委發布《新型抗腫瘤藥物臨床應用指導原則(2018年版)》,其中所涉及的32種藥物中,17種必須進行靶點檢測,共涉及12個靶點。這一方面從官方層面禁止了靶向藥物的濫用,另一方面也為臨床診斷,特別是分子診斷領域帶來了機會。
9月21日,國家衛生健康委醫政醫管局公開發布了《新型抗腫瘤藥物臨床應用指導原則(2018年版)》(以下稱“指導原則”),以國家機構的層面對抗腫瘤藥物的臨床應用提供了官方的指導意見。
隨著我國癌癥發病人數的增加和新藥開發上的突破,腫瘤創新藥成為各家藥企的開發熱點,也是投資方的重點關注的領域之一。在此背景下,國家衛健委以官方身份公布的臨床藥物指導原則,對未來腫瘤藥物的開發和應用有著指導意義。
合理應用受到重視,為基因檢測帶來機會
根據《指導原則》,抗腫瘤藥物是否合理,基于兩個方面:有無應用指征;選用品種及給藥方案是否適宜。
在應用指征上,《指導原則》明確指出,靶向藥物必須經過國家藥品監管部門批準的基因檢測后方可使用,不得在未做相關檢查的情況下盲目用藥。《指導原則》明確列出必須進行基因檢測的藥物以及所需檢測的項目(表1)。
表1:所列基因檢測項目及需要檢測靶點的藥物
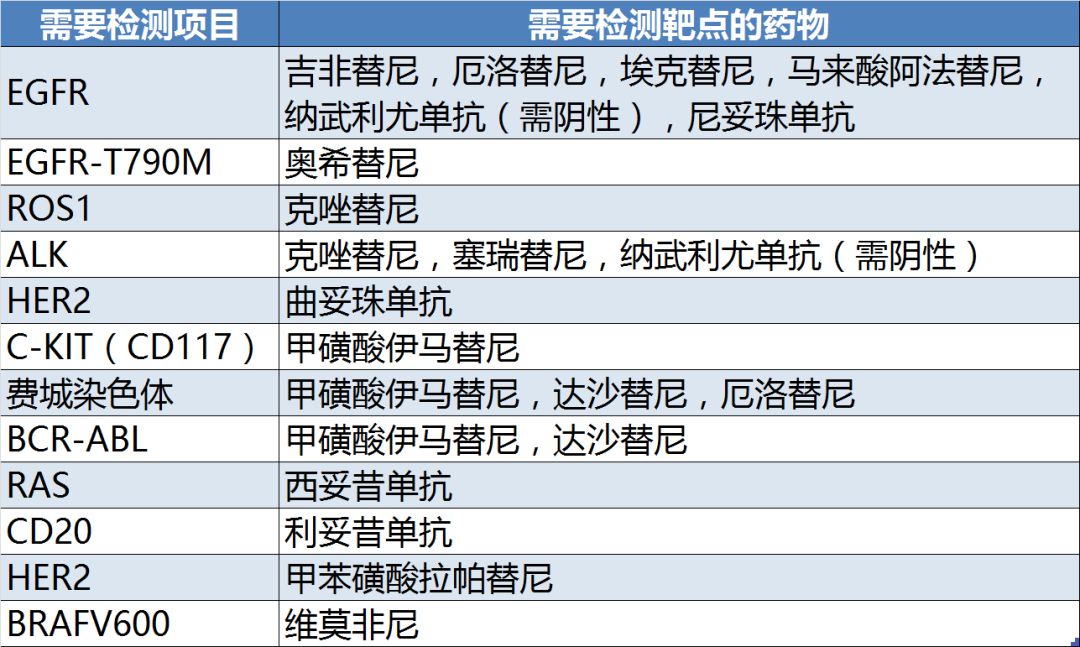
《指導原則》所涉及的32種藥物中,17種必須進行靶點檢測,共涉及12個靶點。這一方面從官方層面禁止了靶向藥物的濫用,另一方面也為臨床診斷,特別是分子診斷領域帶來了機會。隨著越來越多的靶向藥的上市,對伴隨診斷產品的需求相信也會隨之增加。
嚴格按適應癥用藥的同時,及時采納最新用法
《指導原則》指出,腫瘤藥物的臨床應用必須遵循說明書,不能隨意超適應癥使用。但另一方面,文件中也提及,隨著治療臨床實踐的快速發展,藥品說明書往往滯后于臨床實踐,因此允許特殊情況下的超適應癥使用。
特殊情況下抗腫瘤藥物的使用僅限于三級醫院授權的具有高級專業技術職稱的醫師,采納根據依次是:其他國家或地區藥品說明書中已注明的用法,國際權威學協會或組織發布的診療規范、指南,國家級學協會發布的經國家衛生健康委員會認可的診療規范、指南。
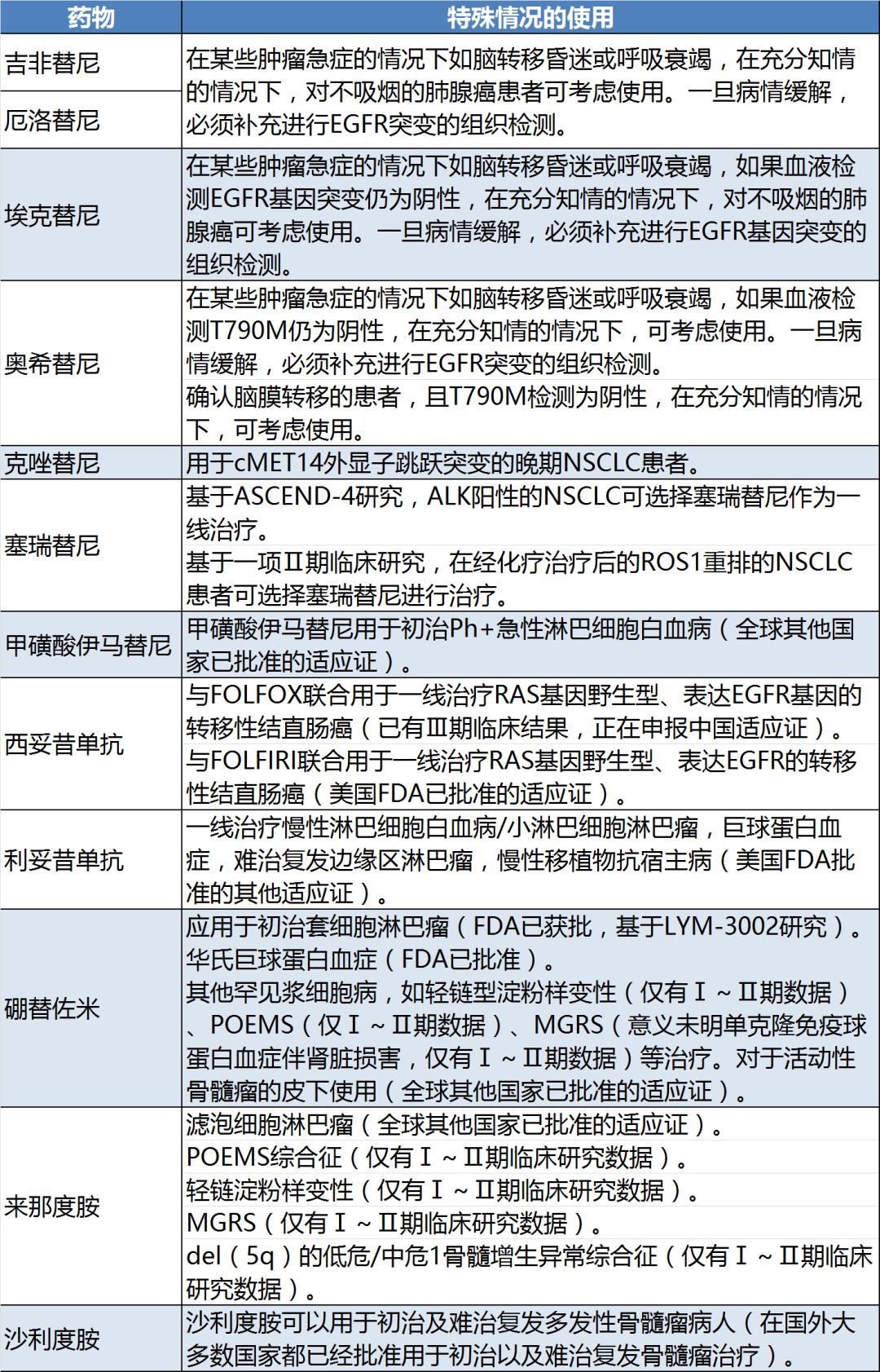
此次《指導原則》所涉及的33種藥物中,有12個藥物列明了特殊情況下的超適應癥使用(表2)。特別值得一提的是,沙利度胺的說明書適應癥僅為麻風病,并不是抗腫瘤藥物,但被作為抗腫瘤藥物列入《指導原則》,用于初治及難治復發多發性骨髓瘤。 這一舉措說明,在嚴格用藥管理的同時,衛健委正積極與國際最新研究接軌,推動國外已獲批的適應癥在國內的應用。
表2:《指導原則》中提及的特殊情況使用
分級管理,國家談判品種重要性凸顯
《指導原則》首次提出了抗腫瘤藥物臨床應用的分級管理。文件指出,在臨床應用中,應當優先選擇藥物經濟學評價和效價比高的藥品。根據藥物適應證、藥物可及性和腫瘤治療價值,將抗腫瘤藥物分成兩級(見表3)。
表3:《指導原則》抗腫瘤藥物使用分級

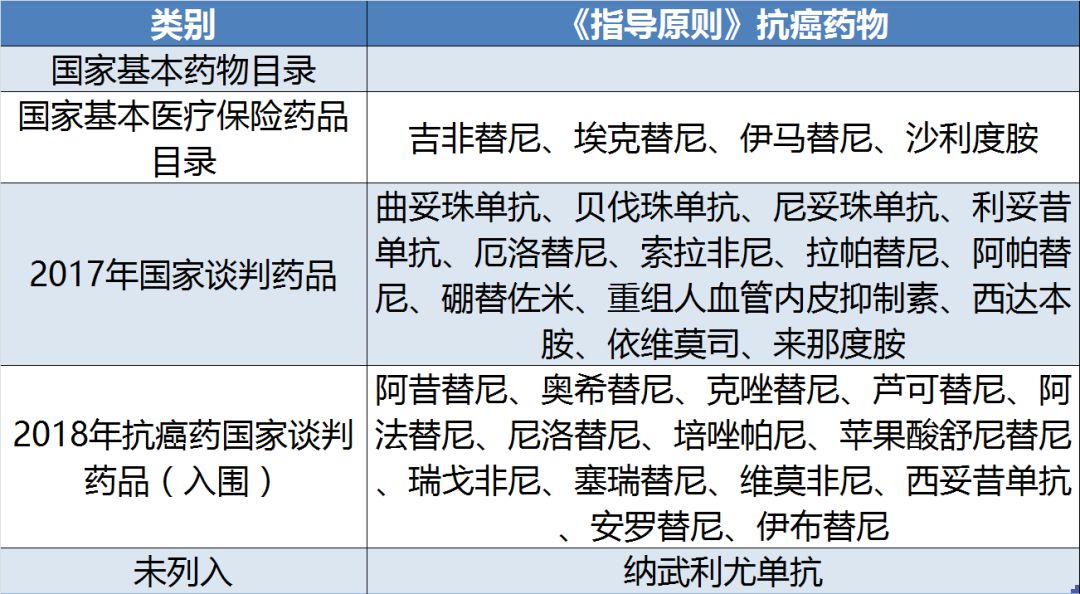
有意思的是,分類標準是根據藥物是否進入三個與醫保支付密切相關的藥物目錄來考量的,并且絕大多數為2017年國家談判藥品和2018年抗癌藥國家談判入圍品種(見表4)。唯一未列入藥物目錄的品種是今年6月剛獲得批準的創新機制首個PD-1抑制劑納武利尤單抗。
2017年國家談判藥品中15個非中藥抗腫瘤藥物中,除阿比特龍和氟維司群以外,均進入《指導原則》。而2018年國家抗癌藥專項談判入圍的18個藥物中,僅4個藥物:枸緣酸伊沙佐米、培門冬酶、阿扎胞苷和醋酸奧曲肽微球4個藥物未列入《指導原則》。由此可見,國家談判藥物的藥物經濟學價值和性價比受到國家衛健委的肯定。通過國家談判獲得醫保支付的品種有望在臨床獲得優先使用。
表4:《指導原則》藥物列入國家目錄情況
大多數產品是仿制熱點,多家公司競相研發
筆者梳理了本次《指導原則》所涉及的32個抗腫瘤新藥,發現這些藥物都是開發熱點,雖然目前大多還處在臨床開發階段,但預期未來產品紛紛上市后,市場競爭會非常激烈。
除了6個國內企業開發的原研藥外,大多數品種已有公司正在研發仿制藥(或生物類似藥),其中吉非替尼、伊馬替尼、達沙替尼、硼替佐米和來那度胺已有國產仿制藥上市(表5)。
表5:《指導原則》新型抗腫瘤藥物競爭態勢
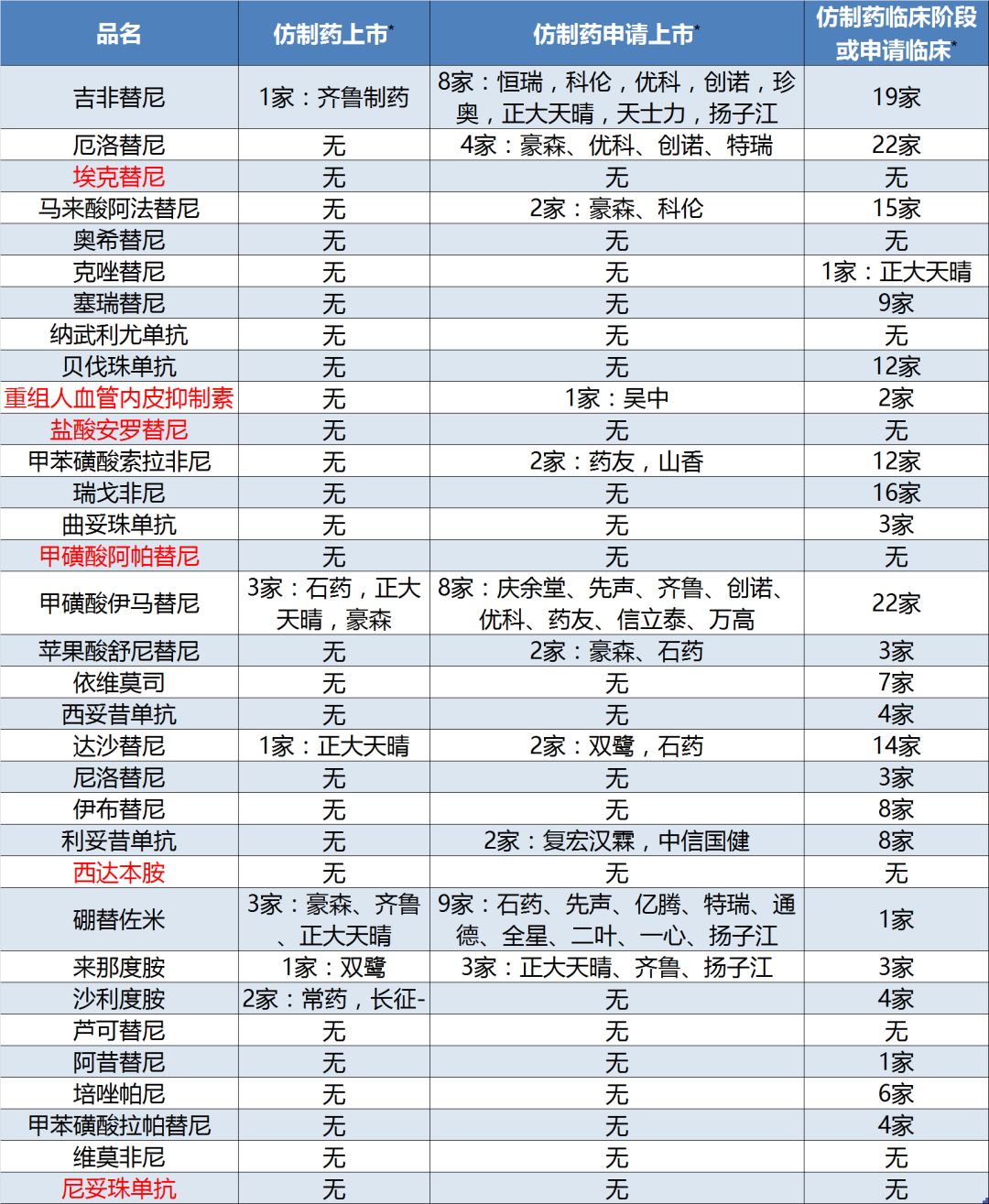
注:1、仿制藥,包括大分子藥物的生物類似藥;2、標紅為國產藥企原研產品
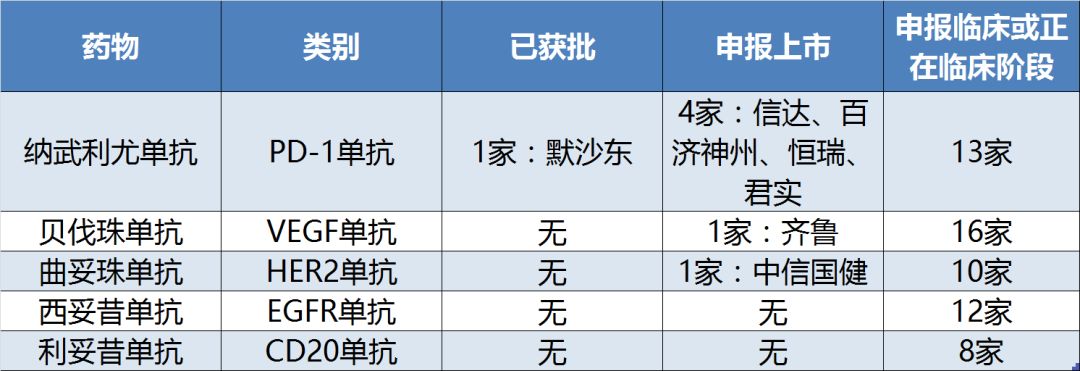
對于其中的大分子單抗藥物而言,一些靶點,如PD-1、VEGF、HER2、EGFR和CD20也是當仁不讓的開發熱點,絕大多數有超過10家公司正在積極開發針對該靶點的產品(表6)。
表6:《指導原則》部分熱門靶點的單抗藥物
|