涉嫌“違反人類遺傳資源管理規定”,華大、華山醫院、藥明康德等機構被處罰
日期:2018/10/25
【云端導讀】
國家科技部發布六份行政處罰書,深圳華大基因、復旦大學附屬華山醫院、蘇州藥明康德、昆皓睿誠醫藥、廈門艾德生物以及阿斯利康六家企業被處罰,然而這些處罰書下發時間最早的是2015年,其次是2016年和2018年7月,為何今日才在官網上掛出?

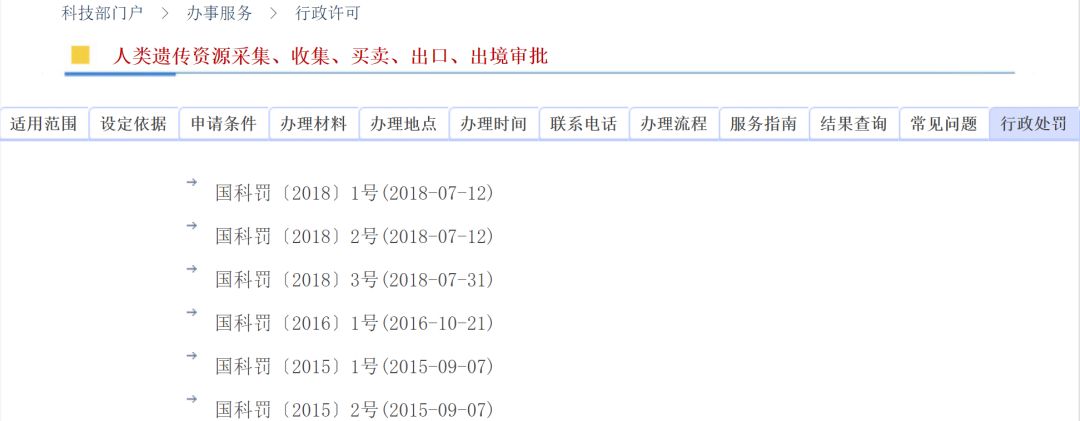
今日(10月24日),國家科技部發布六份行政處罰書,時間分別是2015年9月7日、2016年10月21日、2018年7月31日、2018年7月12日。令人不解的是,這些處罰書最早是三年前就已下發,為何今日才在官網上掛出?
什么是人類遺傳資源管理規定?
老實說,小編也不知道這是個什么規定,于是帶著好奇心搜索了一下國家科技部官網,發現了2016年3月7日的一篇報道:
我國系統全面的人類遺傳資源管理始于1998年。這一年,第一個人類遺傳資源管理的法規文件《人類遺傳資源管理暫行辦法》出臺,對管理體制、國際合作和出境活動的審批程序做出了規定。人類遺傳資源管理專家組成員甘榮興認為,這填補了我國人類遺傳資源管理的空白。
“此前,申辦方發起的新藥臨床試驗由國家藥品監督管理部門來監管,主要監管內容是新藥的安全性和有效性,對新藥臨床試驗過程中涉及對受試者采樣保護、人類遺傳資源合理使用等方面的關注比較少。
研究者發起的藥物臨床研究沒有國家相關部門來監管,對藥物臨床研究過程中涉及對受試者采樣保護、人類遺傳資源合理使用、完整的受試者知情同意、規范的倫理審批、知識產權分享和相關管理制度等方面的關注極少”甘榮興說,彼時,人類遺傳資源領域多頭管理,分散無序。
但隨著藥物臨床試驗領域的國際合作日益緊密,人類遺傳資源管理嚴重落后于國際通行規則與做法,制約了我國藥物臨床試驗 GCP建設。
甘榮興舉例道,比方外方藥企出資資助國內研究者發起的藥物臨床研究,所有的知識產權都歸外方藥企,而美歐國家的通行做法是根據實際貢獻情況由研究者獨享或與外方藥企分享知識產權;
再比如,有些單位將新藥臨床試驗剩余的樣本、或者有意在新藥臨床試驗過程中多采集受試者的樣本在知情同意書內容和倫理批準的范圍之外挪作他用,等等。
“我覺得這些年人類資源管理工作的實施對新藥研發臨床試驗相關人員理念上的更新起了重要的推動作用。”北京大學第三醫院藥物臨床試驗機構主任李海燕說。
她坦陳,此前很多人并未意識到人類遺傳資源管理在新藥臨床試驗中的重要性。但近年來,隨著人類遺傳資源管理的不斷推進,特別是去年10月份后,科技部組織了大規模的培訓,大家對人類遺傳資源的合理利用和保護的意識越來越強。
“各研究單位的倫理委員會及相關臨床試驗管理機構在受試者的知情同意、合作單位的知識產權分享、樣品出境等各方面都逐步建立了涉及人類遺傳資源管理的相關規范。”李海燕說。
通過實施人類遺傳資源行政許可管理工作特別是建立“一縱一橫一支撐”管理機制以來,政府各管理部門的權責更明確、流程更清楚、銜接更順暢、監管更到位,不會出現重復多頭管理的情況,申報單位對申報、批準和辦理人類遺傳資源出境的相關流程和手續更清晰,使人類遺傳資源出境更順暢。
甘榮興具體闡述道,人類遺傳資源管理的行政審批通過對國際合作開展藥物臨床試驗過程中涉及人類遺傳資源使用的關鍵環節的審核,如知情同意書的完整性、受試者簽署知情同意書,醫學倫理委員會的組建、制度建設、規范審批,在知情同意書中明確和倫理批準的范圍內合理使用人類遺傳資源種類、數量和生物安全,中外合作雙方權利義務和知識產權分享通過合作協議明確,申報單位有關人類遺傳資源管理的相關管理制度,相關項目執行的材料完整、可溯源和歸檔等方面,使國際合作項目執行不斷規范,相關制度不斷建立健全,知情同意和倫理審批比較規范,人類遺傳資源更合理使用。
規范的人類遺傳資源管理促進了我國臨床藥物試驗 GCP的建設。例如,北京大學第一附屬醫院通過參加23項國際多中心臨床藥物研究合作,不僅促進這些藥物在我國的上市,而且在試驗中積累了國外原研藥臨床研發的經驗,改善了臨床試驗硬件條件,規范了操作,完善了管理體系,培養了團隊,逐漸成為國內領先,具有國際水平的臨床 GCP基地。
針對MAH,優化人類遺傳資源行政審批流程

而2017年10月26日,國家科技部又發布通知,科技部研究制定了針對為獲得相關藥品和醫療器械在我國上市許可,利用我國人類遺傳資源開展國際合作臨床試驗的優化審批流程。
新的審批流程中優化的內容主要包括鼓勵多中心臨床研究設立組長單位,一次性申報;臨床試驗成員單位認可組長單位的倫理審查結論,不再重復審查;具有法人資格的合作雙方共同申請;
調整提交倫理審查批件、食品藥品監管總局出具的臨床試驗批件的時間,由原來的在線預申報時提交延后至正式受理時提交;取消省級科技行政部門或國務院有關部門科技主管單位蓋章環節等方面。該審批流程自2017年12月1日起施行。
人類遺傳資源審批不是新藥開發的限速因素
在2017年9月26日的DIA中國第三屆藥物研究創新大會上,來自國家科技部社會發展科技司醫藥處官員做了“國家科技創新規劃的重要舉措及人類遺傳資源管理相關法規制定”的演講。
目前科技部在人類遺傳資源上的管理體制,以及為了簡化流程,加快審批所采取的多種方式。科技部為優化審批流程所做的不懈努力,包括建立組長申報制,方案為申請主體,合作各方共同申報,并行審查以及“一站式”受理等多種方式。這些改革措施對《暫行辦法》的一些流程進行優化,
此外,遺傳辦還對申請書進行優化,比如將申請表格化等,大大減輕了申辦方的填報負擔,為企業創新助力。從目前審批情況及優化后的流程來看,人類遺傳資源審批并不構成新藥開發的明顯限速因素。
以下是處罰書詳細內容:
行政處罰決定書
國科罰〔2015〕2號
單位名稱:深圳華大基因科技服務有限公司
地 址:廣東省深圳市鹽田區北山工業區綜合樓
法定代表人:劉娜
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室(以下簡稱遺傳辦)對深圳華大基因科技服務有限公司(以下簡稱華大科技)執行“中國女性單相抑郁癥的大樣本病例對照研究”國際科研合作情況進行了調查,現已調查終結。經查明,存在以下違法違規行為:
華大科技與華山醫院未經許可與英國牛津大學開展中國人類遺傳資源國際合作研究,華大科技未經許可將部分人類遺傳資源信息從網上傳遞出境。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條、第十一條、第十六條規定。現根據《人類遺傳資源管理暫行辦法》第二十一條及《中華人民共和國行政處罰法》有關規定,決定處罰如下:
1.你單位應于接到本決定書之日起立即停止該研究工作的執行。
2.銷毀該研究工作中所有未出境的遺傳資源材料及相關研究數據。
3.自本決定書送達之日起停止華大科技涉及我國人類遺傳資源的國際合作,整改驗收合格后,再行開展。
你單位如不服本處罰決定,可在收到本行政處罰決定書之日起60日內向科技部申請行政復議,也可以在6個月內向有管轄權的人民法院提起行政訴訟。復議和訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
中華人民共和國科學技術部
2015年9月7日
行政處罰決定書
國科罰〔2015〕1號
單位名稱:復旦大學附屬華山醫院
地 址:上海烏魯木齊中路12號
法定代表人:丁強
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室(以下簡稱遺傳辦)對復旦大學附屬華山醫院(以下簡稱華山醫院)開展的“中國女性單相抑郁癥的大樣本病例對照研究”國際科研合作情況進行了調查,現已調查終結。經查明,存在以下違法違規行為:
華山醫院與深圳華大基因科技服務有限公司未經許可與英國牛津大學開展中國人類遺傳資源國際合作研究,華山醫院未經許可將部分人類遺傳資源信息從網上傳遞出境。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條、第十一條、第十六條規定。現根據《人類遺傳資源管理暫行辦法》第二十一條及《中華人民共和國行政處罰法》有關規定,決定處罰如下:
1.你單位應于接到本決定書之日起立即停止該研究工作的執行。
2.銷毀該研究工作中所有未出境的遺傳資源材料及相關研究數據。
3.自本決定書送達之日起停止華山醫院涉及我國人類遺傳資源的國際合作,整改驗收合格后,再行開展。
你單位如不服本處罰決定,可在收到本行政處罰決定書之日起60日內向科技部申請行政復議,也可以在6個月內向有管轄權的人民法院提起行政訴訟。復議和訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
中華人民共和國科學技術部
2015年9月7日
行政處罰決定書
國科罰〔2016〕1號
單位名稱:蘇州藥明康德新藥開發股份有限公司
地 址:蘇州市吳中區吳中大道1318號
法定代表人:李革
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室對蘇州藥明康德新藥開發股份有限公司(以下簡稱蘇州藥明康德公司)涉嫌違反人類遺傳資源管理規定一案進行調查,現已調查終結。經查明,存在以下違法違規行為:
蘇州藥明康德公司未經許可將5165份人類遺傳資源(人血清)作為犬血漿違規出境。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條、第十六條規定。現根據《人類遺傳資源管理暫行辦法》第二十一條及《中華人民共和國行政處罰法》有關規定,決定處罰如下:
1.對蘇州藥明康德公司進行警告。
2.沒收并銷毀該項目中人類遺傳資源材料。
3.自本決定書送達之日起,科技部暫停受理蘇州藥明康德公司涉及我國人類遺傳資源的國際合作和出境活動的申請,整改驗收合格后,再予以恢復。
根據《中華人民共和國行政處罰法》第三十二條規定,你單位如不服本處罰決定,可在收到本行政處罰決定書之日起60日內向科技部申請行政復議,也可在6個月內向有管轄權的人民法院提起行政訴訟。復議和訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
中華人民共和國科學技術部
2016年10月21日
行政處罰決定書
國科罰〔2018〕3號
單位名稱:昆皓睿誠醫藥研發(北京)有限公司
地 址:北京經濟技術開發區涼水河二街8號院15號樓302
法定代表人:張艷
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室對昆皓睿誠醫藥研發(北京)有限公司(以下簡稱“昆皓睿誠”)違反人類遺傳資源管理規定一案進行調查,現已調查終結。經查明,存在以下違法違規行為:
昆皓睿誠未經許可接收阿斯利康投資(中國)有限公司567管樣本并保藏。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條和第十一條規定。根據《中華人民共和國行政處罰法》和《人類遺傳資源管理暫行辦法》有關規定,決定處罰如下:
1.對昆皓睿誠進行警告。
2.沒收并銷毀違規利用的人類遺傳資源材料。
根據《中華人民共和國行政處罰法》第三十二條規定,你單位如不服本處罰決定,可在收到本處罰決定書之日起60日內向科技部申請行政復議,也可以在6個月內向有管轄權的人民法院提起行政訴訟。復議和訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
中華人民共和國科學技術部
2018年7月31日
行政處罰決定書
國科罰〔2018〕2號
單位名稱:廈門艾德生物醫藥科技股份有限公司
地 址:廈門市海滄區鼎山路39號
法定代表人:LI-MOU ZHENG
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室對廈門艾德生物醫藥科技股份有限公司(以下簡稱“廈門艾德”)違反人類遺傳資源管理規定一案進行調查,現已調查終結。經查明,存在以下違法違規行為。
廈門艾德未經許可接收阿斯利康投資(中國)有限公司30管樣本,擬用于試劑盒研發相關活動。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條和第十一條規定。根據《中華人民共和國行政處罰法》和《人類遺傳資源管理暫行辦法》有關規定,決定處罰如下:
1.對廈門艾德進行警告。
2.沒收并銷毀違規利用的人類遺傳資源材料。
根據《中華人民共和國行政處罰法》第三十二條規定,你單位如不服本處罰決定,可在收到本行政處罰決定書之日起60日內向科技部申請行政復議,也可在6個月內向有管轄權的人民法院提起行政訴訟。行政復議和行政訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
科 技 部
2018年7月12日
行政處罰決定書
國科罰〔2018〕1號
單位名稱:阿斯利康投資(中國)有限公司
地 址:中國(上海)自由貿易試驗區亮景路199號
法定代表人:馮佶
根據《人類遺傳資源管理暫行辦法》(國辦發〔1998〕36號)、《中華人民共和國行政處罰法》等有關規定,中國人類遺傳資源管理辦公室對阿斯利康投資(中國)有限公司(以下簡稱“阿斯利康”)違反人類遺傳資源管理規定一案進行調查,現已調查終結。經查明,存在以下違法違規行為。
阿斯利康未經許可將已獲批項目的剩余樣本轉運至廈門艾德生物醫藥科技股份有限公司和昆皓睿誠醫藥研發(北京)有限公司,開展超出審批范圍的科研活動。
上述行為違反了《人類遺傳資源管理暫行辦法》第四條和第十一條規定。現根據《人類遺傳資源管理暫行辦法》第二十二條和《中華人民共和國行政許可法》及《中華人民共和國行政處罰法》有關規定,決定處罰如下:
1.對阿斯利康進行警告。
2.沒收并銷毀違規利用的人類遺傳資源材料。
3. 撤銷國科遺辦審字〔2015〕83號、〔2016〕837號兩項行政許可。
4.自本決定書送達之日起停止受理阿斯利康涉及中國人類遺傳資源國際合作活動申請,整改驗收合格后,再進行受理。
根據《中華人民共和國行政處罰法》第三十二條規定,你單位如不服本處罰決定,可在收到本行政處罰決定書之日起60日內向科技部申請行政復議,也可在6個月內向有管轄權的人民法院提起行政訴訟。行政復議和行政訴訟期間本決定不停止執行。逾期不履行本決定的,本處罰機關將申請人民法院強制執行。
科 技 部
2018年7月12日
信息來源:醫藥云端工作室 |