未通過一致性評價將被注銷批文?完全是誤讀!
日期:2018/11/17
【云端導讀】
無論是國務院辦公廳還是原國家食藥監局的文件,均沒有“通不過一致性評價的品種注銷批文”的規定,至今也未發出正式文件修改或補充。
令人不安的新聞
今天(11月6日),江蘇省人民政府網站轉載《新華日報》的一篇文章在朋友圈引起了軒然大波,這篇文章的標題非常勁爆,也非常令人驚恐:《我省清理仿制藥市場 不通過一致性評價將注銷批文》。
如下面截圖所示:
這篇文章顯示,江蘇省食藥監局藥品注冊管理處處長王宗敏介紹說,為了將藥效欠佳的仿制藥逐出市場,國家要求在年底前對289種納入基本藥物目錄的仿制藥完成質量一致性評價,未通過評價的仿制藥將被注銷批準文號。
令人不安是有原因的
通不過一致性評價的品種就要被注銷批文,這句充滿結論性的判斷句在當前一致性評價工作進入關鍵期顯得非常敏感。
一方面,多省已經對不通過評價品種暫停采購的通知,的確有一些品種因而退出市場;另一方面,289基藥品種大限在即---離2018年12月31日已不足2個月,很多人對此懸著的一顆心,看到江蘇省政府網站的這則報道后更加惶恐不安---江蘇作為醫藥大省、醫藥強省有這樣的規定,而且是省政府網站發出,難道還有假嗎?
一時間,盆友圈刷屏,各個微信群議論紛紛,認為江蘇下重手了,通不過的仿制藥將遭遇滅頂之災!恐怕下一步連江蘇市場包括零售市場都進不去了!而且全國如此效法的話,不知有多少品種批文將要被省級藥監部門注銷!
誤讀的背后:沒有理解一致性評價政策
然而,上述網站轉載的內容及標題相當不嚴謹,甚至誤讀了國家一致性評價的政策,以至于誤導了行業人士對政策的準確判斷。作為專業的平臺,醫藥云端工作室有必要對此事較較真。
事實上,對于一致性評價的退出機制,國務院辦公廳及原國家食藥監總局的兩個重要文件說的很清楚。
2016年2月6日,《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)明確:
國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿制藥口服固體制劑,應在2018年底前完成一致性評價,其中需開展臨床有效性試驗和存在特殊情形的品種,應在2021年底前完成一致性評價;逾期未完成的,不予再注冊。
化學藥品新注冊分類實施前批準上市的其他仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價;逾期未完成的,不予再注冊。
以上文件將仿制藥劃分為3種情況并規定了時間限制,簡而言之:
1、【289目錄品種】國基520品種中2007年10月1日前批準上市的化學藥品仿制藥口服固體制劑(即289目錄品種),應在2018年底前完成一致性評價;
2、【289目錄中存在特殊情況的品種】最遲不能超過2021年底前完成評價;
3、【化學藥品新注冊分類實施前批準上市的其他仿制藥】自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價;逾期未完成的,不予再注冊。
請看,上述三種情況,雖然規定的“時間大限”及退出方式不同,但均沒有提及注銷藥品批文的情況,更沒有“不通過一致性評價就注銷批文”的規定。
2016年5月25日,原國家食藥監總局發布關于落實《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》有關事項的公告(2016年第106號),該公告在退出方式上與國辦發〔2016〕8號)略有不同,但行文表述上,同樣沒有注銷批文的規定。
(二)凡2007年10月1日前批準上市的列入國家基本藥物目錄(2012年版)中的化學藥品仿制藥口服固體制劑(附件),原則上應在2018年底前完成一致性評價。
(三)上述第(二)款以外的化學藥品仿制藥口服固體制劑,企業可以自行組織一致性評價;自第一家品種通過一致性評價后,三年后不再受理其他藥品生產企業相同品種的一致性評價申請。
CFDA與國辦發〔2016〕8號)文件不同之處在于:
國辦發〔2016〕8號):化學藥品新注冊分類實施前批準上市的其他仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價;逾期未完成的,不予再注冊
CFDA2016年第106號文:上述第(二)款以外的化學藥品仿制藥口服固體制劑,企業可以自行組織一致性評價;自第一家品種通過一致性評價后,三年后不再受理其他藥品生產企業相同品種的一致性評價申請。
對比兩者文字可發現,CFDA文件與國務院文件顯得較為寬松,三年時間到期只是“不再受理一致性評價申請”而已,并沒有說后面怎么處理?沒說不再注冊,更沒說注銷批文。這樣的表述在分析人士看來,也許為后面實在不能通過的品種留下了一條后路,或許,正因為如此,很多仿制藥廠家對一致性評價工作不太積極,處于觀望狀態,估計這也是造成評價工作進展緩慢的原因之一。
綜上所述,無論是國務院辦公廳還是原國家食藥監局的文件,均沒有“通不過一致性評價的品種注銷批文”的規定,至今也未發出正式文件修改或補充。
因此,結合江蘇省政府轉載的《新華日報》文章內容,我們認為這多半是媒體編輯不熟悉醫藥行業政策而曲解了之故,不值得大肆渲染大驚小怪,更不能以此推論江蘇省下一步將全面封殺未通過評價的品種。
當然,也有一些朋友認為,難道省級政府不可以比國家政策更嚴?但問題是省級藥監部門沒有注銷藥品批文的權限啊!
關于采購3個通過仿制藥的誤讀
此前,業界就很有一批人士看到采購政策中涉及“3個”字樣時,不求甚解,誤以為國家只需要通過一致性評價的前3個品種,后面未通過的品種就要退出市場。實際上,包括國家及省級采購部門的文件是“當有3個通過一致性評價品種后,不再采購未通過的仿制藥”的規定,暫停采購后,只要能通過評價,照樣能重返市場,當然,能不能中標,中標價格多少那是后話。
江蘇仿制藥一致性評價走在全國前列
不過,一碼事歸一碼事,江蘇不愧是醫藥強省,一致性評價工作走在全國前列,據《新華日報》報道,截至10月底,江蘇省對口服固體制劑451個藥品開展一致性評價,涉及93家企業254個品種,完成研究并獲受理62個品規,數量居全國第一;獲批16項,數量居全國第二。
一致性評價進展:已有6品規集滿3家,19個基藥通過一致性評價
據醫藥云端工作室統計,目前已有6個品規集滿3家企業通過一致性評價,其中瑞舒伐他汀鈣片已有4家,2018年底大限即將到來,盡管有些品種并不是289基藥目錄內的,但是搶占市場優勢也是相當重要的,各企業都在和時間賽跑啊。
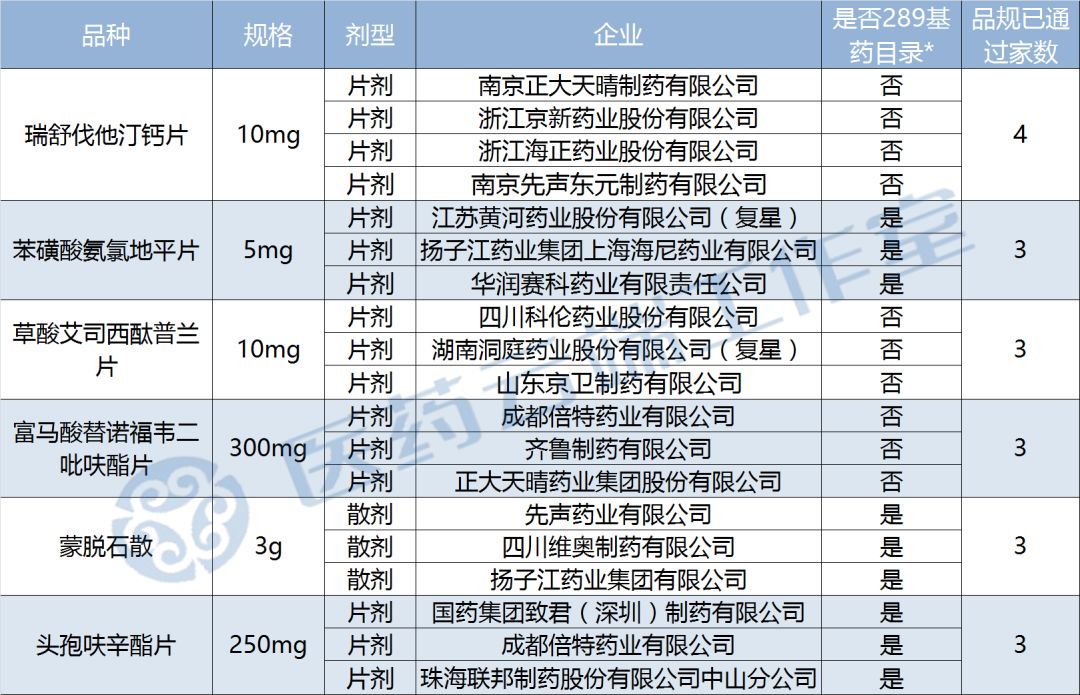
截至今日,醫藥云端工作室通過此前國家藥監局公布的五批通過目錄、企業公告以及上市目錄集三個渠道統計,共105個品規通過(或視同通過)一致性評價,涉及品種共58個,其中屬289目錄的品種只有19個,完成度僅為6.57%。
信息來源:醫藥云端工作室 |