帶量采購今年可能很難試點
日期:2018/11/17
券商中國(quanshangcn)
11月1日這天,醫藥行業有兩件大事。一是全國人大就藥品管理法修正草案等4部法律修正案征求意見;二是總書記召開的民營企業座談會上,恒瑞醫藥董事長孫飄揚代表醫藥行業做了發言,并得到了總書記的回應。從兩個事件來看,法律和政策調整對醫藥行業的負面影響或沒那么大,甚至不能認為是負面影響。
“帶量采購”今年可能很難試點
據新華社等的公開信息,總書記召開的民營企業座談會上,恒瑞醫藥孫飄揚作了主題為“營造產業自主創新環境,提升民族藥企核心競爭力”的發言,并就進一步優化創新藥鼓勵政策制度、穩妥開展一致性評價藥品的集中采購試點工作以及合理降低企業成本建言獻策。
總書記的回答是:“你說的這幾個問題,中央深改委已經有頂層設計,關鍵是要落實。”由此分析,“帶量采購”是方向,但目前通過一致性評價的品種還很少,時機還不成熟,相關試點今年可能很難進行。
國家醫保局的“帶量采購”試點理論上是沒問題的。對通過一致性評價仿制藥給出11個城市一年用量70%的市場份額,藥企以藥價下降10%—40%作為交換。因為醫保局直接談判、采購,可以擠壓掉推廣費用、回扣、二次議價等環節成本,實現藥價降低,所以,方向是沒有錯。問題是,推行這項政策時需要解決好幾個問題。
一是國務院仿制藥一致性評價政策與醫療部門的規定有沖突。國辦發《關于開展仿制藥質量與療效一致性評價的意見》文件中規定:“通過一致性評價的藥品品種,在醫保支付方面予以適當支持,醫療機構應優先采購并在臨床中優先選用。同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種。”
仿制藥一致性評價就是國產仿制藥要達到進口原研藥的質量標準,而要做一致性評價,藥企需要投入500-1000萬元,所以,上述政策要有這樣鼓勵條款。但醫療部門有“一品兩規”的規定,即一個藥品只能有兩家藥企4個規格的產品進入醫院,也就是通過一致性評價的三家藥企間還是要打價格戰,還是要給醫生回扣來激勵他們多開自家的藥。目前,只有一些地方表態要打破“一品兩規”的限制。
二是“帶量采購”如果只是一家中標,對藥企來說是零和游戲,要么中標,要么出局,所以,導向上會推動藥企壓價格、降成本,那樣,又變成了價格取向,中標的藥品質量不一定能保證,與一致性評價提高質量的本意違背。
三是試點方案未明確“帶量采購”的年限,如果一年一招標,不僅會導致價格戰惡化,質量難保證;而且,藥企會擔心今年中標明年出局,不敢擴產,中標的藥企可能滿足不了采購量,這樣會帶來未中標藥企反而賣高價的怪現象。
四是“帶量采購”給了低價中標的預期,導致藥企形成了“不做一致性評價等死、做了一致性評價找死”的看法,從而影響了一致性評價的積極性。
所以,“帶量采購”試點既要做好與醫療等部門、地方的政策協調,在方案設計上也要避免負面效應的出現。
這邊,生產仿制藥的國內企業在為“帶量采購”煩惱,那邊,不少專利過期原研藥正在逆勢增長。輝瑞過了專利期的利普妥(阿托伐他汀鈣片)每片8、9元,通過一致性評價仿制藥的價格是5、6元,價差30%;同時,利普妥在美國的銷售已降到了2億美元,但在中國年銷售是12億美元。賣得貴又賣得好的后面,是進口藥的招標政策不合理。據某醫藥行業協會權威人士說,目前過專利期藥品的年銷售額在4000多億元,如果讓過專利期的原研藥價格降到接近通過一致性評價仿制藥的水平,藥品支出可以降掉一半。
藥品價格體系的畸形,可能不是一個“帶量采購”能解決的,需要從更高的層面、從部門的政策協調來統籌改革。
藥品管理法修正草案化解了市場對疫苗行業的擔心
全國人大在藥品管理法修正草案征求意見說明中說,吉林長春長生公司問題疫苗案件發生后,黨中央、國務院要求汲取教訓,舉一反三,抓緊完善相關法律法規,加快完善疫苗藥品監管長效機制。2018年9月,市場監管總局向國務院報送了《中華人民共和國藥品管理法修正案(草案送審稿)》。送審稿圍繞問題疫苗案件暴露的突出問題,對藥品監管制度作了完善,同時,對藥品上市許可持有人制度作了規定。
10月26日,全國人大常委會第六次會議分組審議了藥品管理法修正草案,但未獲通過,這次應該是廣泛征求民意。
從草案內容來看,專門針對疫苗的主要有四點;一是藥品監督管理部門應當對疫苗等生物制品實施重點監督檢查;二是疫苗、血液制品、麻醉藥品、精神藥品、醫療用毒性藥品不得委托生產,但是,國務院藥品監督管理部門規定可以委托生產的情形除外;三是在疫苗的研制、生產、流通、預防接種過程中應當采用信息化手段采集、留存追溯信息;四是實行疫苗責任強制保險制度。第二點是對藥品上市許可持有人的特殊規定,第四點引進了保險賠償機制,其余兩點在國家藥監局的相關規定里已有體現。
除了專門針對疫苗的條款,修正草案修訂之處主要有這樣幾個方面:
一是完善藥品全過程監管制度,強化企業主體責任,強化藥品生產經營過程管理,藥品上市許可持有人、生產經營企業、醫療機構應當建立、實施嚴格的追溯制度,補充規定了藥品召回制度。
二是明晰藥品監管職責,完善監管措施。
三是加大對違法行為的處罰力度,解決違法成本低、處罰力度弱的問題。罰款的幅度從貨值金額的二倍至五倍提高到五倍至三十倍。長生生物罰款三倍罰款總額就達到了91億元,罰款三十倍足以形成約束力。
四是實施藥品上市許可持有人制度。
五是改革藥品審批制度。為避免短時間內頻繁修法,草案將已經國務院同意的藥品審批改革措施所涉及的條款一并進行了修改。
全國人大常委會審議藥品管理法修正草案時,龐麗娟委員建議,建立藥品的初審制度、藥品審批的終身負責或終身追究制度。吳恒委員建議在修正草案當中明確給疫苗制定相關法律留出空間。陳竺副委員長說,藥品問題是重大的民生問題和公共安全問題,建議進一步完善藥品安全事件公眾溝通機制。這個建議極具針對性,也非常重要。國家藥監局在對長生生物狂犬病疫苗飛檢期間,吉林藥監局突然發布了百白破處罰公告。問題是,發布處罰公告的同時,未有已接種問題百白破疫苗的針對性措施同步發布才導致了民眾的恐慌。
綜合來看,藥品管理法修正草案的重點是對疫苗行業加強監管、責任追究,加大處罰力度,建立保險制度,使受害者得到合適的經濟補償。至于吳恒委員建議的對疫苗制定專門的制度,9月20日,中央全面深化改革委員會第四次會議審議通過了《關于改革和完善疫苗管理體制的意見》。
從會議消息來看,大致有四點內容,除了盡快解決疫苗藥品違法成本低、處罰力度弱等突出問題外,主要是嚴格市場準入、強化市場監管;優化流通配送,規范接種管理,堅決堵塞監管漏洞;要發揮國有企業和大型骨干企業的主導作用,加強疫苗研發創新、技術升級和質量管理。從這些內容來看,疫苗上市公司將受惠于改革和完善疫苗管理體制,獲得做強做大的空間。至于會不會專門制定疫苗法,那是下一步的事情。
全國人大在藥品管理法修正草案審議未通過后馬上向公眾征求意見,或意味著先完成修正案,下一步再全面修訂藥品管理法。
流感疫苗短缺和諾如病毒無藥可治藥品審批資源究竟該怎么用?
據一些地方媒體報道,10月以來,無錫、南昌、合肥的幾所小學出現學生集中感染諾如病毒。諾如病毒是一種傳染性很強的致嘔吐和腹瀉的腸道病毒,傳播途徑多樣,每年10月到次年3月是高發季節。目前沒有諾如病毒疫苗,也沒有特異抗病毒藥物。唯一有的是,智飛生物申報了重組諾如病毒多價疫苗臨床試驗申請。
流感流行季也已到來,人們對去年流感暴發還記憶猶新,但發現今年可能接種不上流感疫苗了。不只是今年新批的四價流感疫苗供給不足,就是三價流感疫苗至9月底的批簽發數量也只是去年的一半。背后有長生事件和主力廠商北京科興內斗的原因,但藥品審批資源未合理向疫苗調整也是一個因素。
中鐘注意到,目前在技術審評階段的流感疫苗上市申請共有4個。10月11日,長生生物申請的兒童四價流感疫苗完成了技術審評,10月12日,華蘭生物申報的兒童四價流感疫苗完成了技術審評完,其余2個,一個臨床還未審完,一個臨床和藥學均未審完。這樣的審評狀態不僅讓人起疑,長生生物已無生產疫苗的資格,為何審評照常推進?而作為專業部門對今年流感仍可能暴發應有預判,為何華蘭生物等企業的申請不能加快推進?如果今年流感仍然大暴發,責任算誰的?
審批優先的另一面,對進口抗癌藥的審批可謂神速。特別是,10月30日,國家藥品監督管理局會同國家衛生健康委員會組織起草了《臨床急需境外新藥審評審批工作程序》,建立專門通道對臨床急需的境外已上市新藥進行審評審批,對罕見病治療藥品,在受理后3個月內完成技術審評;對其他境外新藥,在受理后6個月內完成技術審評。這個審評速度是快于目前優先審批速度的。審評審批資源是有限的,對進口抗癌藥等加速審批勢必會使其它藥品的審批速度慢下來。
醫學界的共識是,傳染病是對人類最大的“殺手”,接種疫苗是目前人類預防傳染病最有效的手段。同時,如四價流感疫苗,國內企業不能生產或生產不足只能依靠進口,所以,不能從臨床的重要性還是經濟性角度來說,疫苗的審評審批都應該擺在最優先的位置。加快審批臨床急需境外新藥固然重要,但不能因此影響疫苗的審批效率。
總書記召開民營企業家座談會的目的,是要推動民營企業的發展。那么,作為藥品審批部門,是否應該加快國內走在前面的創新藥,或與國外進展差不多同步的新藥?所以,藥品審批資源的使用值得探討。
最高領導人回應了孫飄揚關于帶量采購等存在問題的政策的反饋……
E藥經理人
最高規格會議,最高領導人就恒瑞醫藥孫飄揚所坦言的,“目前產業政策的某些環節仍存在瓶頸。”問題給出了回答。
11月1日,十 八大以來首次以最高規格的一次民營企業座談會,最高領導人主持召開。
座談會上,劉積仁、魯偉鼎、王小蘭、孫飄揚、盧勇、湯曉鷗、劉漢元、談劍鋒、劉屹、耿哲等10位企業家代表先后發言,就新形勢下支持民營企業發展提出意見和建議。
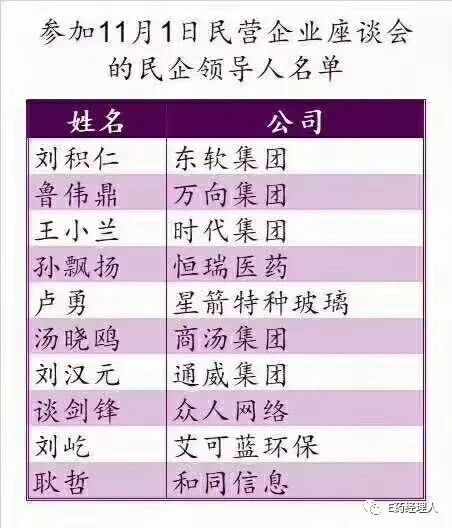
最高領導在會議中指出,當前要抓好6個方面政策舉措落實。一是減輕企業稅費負擔。二是解決民營企業融資難融資貴問題。三是營造公平競爭環境。四是完善政策執行方式。五是構建親清新型政商關系。六是保護企業家人身和財產安全。
值得一提的是,這次會議來自醫療的東軟董事長劉積仁以及恒瑞醫藥董事長孫飄揚發言,占據兩席。從各領域選擇出代表發言,可見國家層面對于醫藥、醫療領域的重視。
那么,這次會議代表都提了哪些建議,最高層是如何回答的?這次會議給中國醫藥、醫療行業傳達了什么樣的信號?

產業政策有問題,最高層這樣回答!
座談會上,恒瑞醫藥董事長孫飄揚作為醫藥行業企業家代表作了主題為“營造產業自主創新環境,提升民族藥企核心競爭力”的發言,他表示,促進我國醫藥產業發展,核心是培育民族藥企的自主創新能力、提高國際競爭力。
另外,孫飄揚還分析了當前我國醫藥行業發展面臨的形勢和挑戰,并就進一步優化創新藥鼓勵政策制度、穩妥開展一致性評價藥品的集中采購試點工作以及合理降低企業成本建言獻策。
而在新華社發布的文章中表示,孫飄揚整體發言的主旨思想是,“目前產業政策的某些環節仍存在瓶頸。”
眾所周知,中國醫藥產業是一個政策型產業。決定企業生死的并非是市場,而是政策。正如此前對于中國醫藥產業發展的描述,“中國醫保有多大,中國醫藥產業就有多大。”實際上,整個中國醫藥產業過去能夠實現快速增長,更多的是來自整個醫保的增長。
顯然,從孫飄揚的發言中,不難看出的,有“瓶頸”的政策是三點,第一是創新藥鼓勵;第二是,一致性評價帶量采購試點政策;第三是合理降低企業成本。
對于孫飄揚所反應的問題,最高領導人的回答是:“你說的這幾個問題,中央深改委已經有頂層設計,關鍵是要落實。”
從回復的角度來看,其背后的深意是,這些問題頂層設計均有考量,只是在落地的時候沒有“落實”到位。
帶量采購有可能暫停?
近來,在不同的渠道有諸多人士向E藥經理人表示,帶量采購試點政策有可能暫停。另外也有人告訴E藥經理人,7+4帶量采購試點政策在2018年12月底前極有可能無法落地。
對此,從此次會議以及E藥經理人從權威部門求證的結果來看,帶量采購一定會落地,只是時間問題。
首先,從部門層面講,帶量采購是在國家醫療保障局成立之前國務院定的政策,算是國家頂層設計,對于國家醫療保障局而言,只是如何落實的問題。
其次,從政策整體層面而言,該政策大邏輯就是通過擠壓掉推廣費用、回扣、二次議價等環節成本,降低藥價,所以從政策制定者角度,是讓利于民的事情,也是邏輯上能夠說清楚的事情,所以具備可執行的理論基礎。
關于帶量采購,此前孫飄揚也未在公開場合發表過對該政策的看法,所以此次大會上具體表述了何種“瓶頸”反饋,我們不得而知。但是在此前的一次會上,恒瑞醫藥總經理周云曙說法值得關注。
對于帶量采購,周云曙的看法是:
“量價掛鉤的大的方向沒問題。但是往往上有政策下有對策。政策很多細節,不能解決醫院2次議價,返利等這些問題。”
“最低價中標與質量導向有背離。企業會加大精力控制成本,精力不會在質量上。也許也合格,但是不是優先質量。”
“獨家高份額,另外30%-40%沒有通過一致性的,也許反而賣高價。”
“中標企業拿到大的訂單,也會考慮明年、后年會不會中標,那會不會只圍繞成本下功夫。”
“不做一致性評價等死,做了一致性評價找死。政策要考慮現有情況,給企業留緩沖期。最低價中標,占有很大份額,有背更多企業通過一致性評價。”
“具體納入品種,國家現在在做289, 但是很多注射劑納入了,這樣有失公平。注射劑過了6個品種,很多沒有大量廣泛市場應用,沒有做過人體試驗。就是因為按照新的注冊類別就給了那么大的市場,有風險。另外有些產品在歐盟、美國有使用的企業,由于國內行政的原因反而不能中標,有失公平。”
“建議避免最低價中標,避免獨家中標。鼓勵競爭充分的納入品種。注射劑暫緩。”
從提建議的角度來看,目前對于帶量采購,關鍵在于落實上的具體細節及配套設施。就目前而言,這套政策,利益相關方來看,跨國藥企、本土藥企、醫療機構、醫生等多個環節都會受到挑戰,所以對于整體推行而言,還需更為周全的計劃和落地節奏以及相關配套政策。
最高層發話“關鍵是要落實”,從目前的所帶來的影響而言,“落實”還存在一些問題,比如在9月11日開的“帶量采購”會議之后,由于醫藥股大跌,所以都將醫藥股下跌算在國家醫療保障局頭上了,至于兩者是否真有關系,我個人認為,有關系,但并不是決定性的因素。
而從整體政策角度而言,該政策的推動過于“激烈”,企業以及市場并為做好準備,反應相對強烈,所以,從政策推進的角度來看,還需要多方配合,逐步打通落地通路,需要一個過渡的環節。
一致性評價對接政策難落地!
眾所周知,仿制藥一致性評價工程,是醫藥領域內一項國家及戰略。但現在的問題卻在于對接政策讓這項工作成為了眾矢之的。
在行業內,對于一致性評價工作持有“不做一致性評價等死,做了一致性評價找死”看法的大有人在。
從最初制度頂層設計層面,對于通過仿制藥一致性評價工作企業是有鼓勵政策,而企業對此期待是:通過一致性評價后能夠奪得更多市場獲得更大收益。
在國辦發《關于開展仿制藥質量與療效一致性評價的意見》文件中,對于通過一致性評價品種的鼓勵政策是:“通過一致性評價的藥品品種,在醫保支付方面予以適當支持,醫療機構應優先采購并在臨床中優先選用。同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方面不再選用未通過一致性評價的品種。通過一致性評價藥品生產企業的技術改造,在符合有關條件的情況下,可以申請中央基建投資、產業基金等資金支持。”
但實際上,雖然各地在支持通過一致性評價工作的品種上先后都出臺了相關政策,鼓勵整體上也有所體現,但是在實際落實執行中卻存在很多問題。
比如說,“一品兩規”的問題,目前除了少數地方有所改變之外,但多數地方依然無法突破“一品兩規”,使得通過一致性評價的仿制藥,在進入醫院時,不少達到兩家以上的通過仿制藥一致性評價的品種,最終還是在仿制藥之間打價格戰。
根據E藥經理人信息顯示,雖然各地開始就一致性評價進行了政策對接,但是從獲得不少主打專利過期原研藥的跨國藥企前三季度增勢頗為喜人,不少專利過期原藥藥正在逆勢增長。
而此次“帶量采購”政策,康恩貝董事長胡季強曾在E藥經理人微信公眾號一篇文章后留言指出:“通過一致性評價后,同一通用名的高價原研藥、高價的仿制藥品種失去了“因為質量層次不同價格不同,但相同報銷比例”的理由,“高價格、高銷售費用”的模式將被“低價格、低費率”替代。以銷售金額占比的市場份額結構將出現較大調整,新藥、中藥特別是創新藥的比重會大幅提升,從而推動制藥產業由仿為主到創為主。但先通過一致性評價品種先試行帶量采購、大幅降價,而未通過品種反而享受高價,會在潛規則作用下促進銷量金額增長,這就很不公平了。”
所以,就目前整體情況來看,對于整個仿制藥一致性評價政策在落地上并沒有實現此前的預期,此前國家的鼓勵政策承諾的也未能如期兌現,對于整個進行一致性評價工作來說,出現了不利情況。究其原因,是各項政策的配套落地,以及政策制定者之間的博弈,缺乏更細致的配套政策所致。
不過,值得一提的是,在此次高規格的會議上,最高領導人提出,要完善政策執行方式。“加強政策協調性,制定相關配套舉措,推動各項政策落地落細落實。”
由此可見的是,在未來各項政策落出臺中,政策制定者需要多方考量,也需要就相關配套政策一并推出,使得各項政策能夠落到實處。
信息來源:萬英會 |