最強解讀!醫藥市場變局看清三大問題,關注四個方向
日期:2018/11/18
有關醫藥、醫療、醫保方面的政策與制度始終左右著醫藥行業已成共識。
有利政策方面:新興醫藥產業發展迅速,生物藥迎來投資高峰期,從事抗體藥物、腫瘤免疫治療藥物、新型疫苗開發的企業增多。大量的資本追逐和投入,一批新的生產場地正在或即將投入建設。藥品創新加快,行業集中度提升,新藥注冊審批改革、一致性評價、MAH制度等政策均向擁有創新藥、高質量仿制藥企業傾斜。輔料與藥包材的關聯評審,亦帶動整個行業提升。
不利或遏制因素包括:受“兩票制”實施影響,大量藥品銷售由“底價”轉為“高開”,全行業主營收入存在相當數量的虛增。由于醫院控費,公立醫院費用增幅要控制在10%以下,“藥占比”不超過30%,再加上限抗、限輔助用藥、限靜脈輸液、限中藥注射劑等中央或地方政策相繼出臺,藥品市場增長趨勢明顯趨緩。原料藥由于環保倒逼而被迫限產,并由此產生“控銷”,致使原料藥價格普漲。化學藥品制劑制造企業既面臨原料藥總體提價,又面對招標迫使化學制劑總體降價的局面,導致許多企業舉步維艱。
因此,目前醫藥行業發展已進入到一個關鍵時期,業內外有關人士必須想方設法最大化利用新政的紅利與新實施制度的傾斜,為企業所用。
壹 新政全景
正確解讀政策大環境
2018年中國醫改新動向
1 衛生總費用占GDP比重將繼續增長
在美國,健康產業對美國GDP的拉動作用在2016年已經達到了19%,而我國總體量到2016年底才到6.2%的水平,因此我國仍然有很大的空間。
2 醫療控費勢在必行
既要控制大處方、大檢查不合理增長,還要注意如果增長太快,超出GDP發展水平、人均可支配收入的承受能力,國家支撐力度也有限。
3 鼓勵非公醫療參與醫聯體、醫共體的建設
如何讓非公立醫療機構(社會辦醫的機構)加入到醫聯體、醫共體的建設中來,讓他們發揮作用,這是今后要著力推進的一項工作。
4 商業保險的發展將是趨勢
把商業保險和基本保險(包括醫療救助、大病保險、應急救助)等各類保障形成有效的功能定位,實施聯動,保障患者的健康。
5 醫保支付方式改革是重點
國家醫療保險將通過支付方式改革、支付標準設定,以及醫保全流程聯動,進一步發揮醫療保險對患者的保障作用,因為這是一件民心工程。
6 公立醫院改革
全面推開綜合改革,全面取消藥品加成,公立醫院功能定位要清晰、運行機制要合理、管理要規范和科學,治理要完善、運行要高效、有可持續性。
供應鏈“蝴蝶效應”
眾所周知,要進行醫改,必須是醫藥、醫療、醫保“三醫聯動”方可完成。供應鏈中的醫藥范疇又可分生產與流通兩大領域,在生產這個領域又可區分為研發與生產兩大部分,銷售則介于生產與流通之間。新政下醫藥供應鏈的變化(現狀與趨勢)詳見表1。
(橫置手機查看)

貳 直面問題
我對三個問題的思考
問題1 一致性評價的政策尺度多大?
答:讓我們首先關注國家藥監局重點推進項目——一致性評價。
2018年是“289基藥目錄通過一致性評價”的大限之年,仿制藥一致性評價成為企業的重中之重。根據國家要求,289目錄品種原則上應在2018年底前完成一致性評價,逾期未完成的不予再注冊。據統計,截至2018年9月底,CDE受理一致性評價受理號共計408個,其中289目錄品種受理號177個,占比43.38%,涉及92家企業的59個品種,有19個品種已通過一致性評價,289目錄品種一致性評價完成率僅6.57%,進展緩慢。
但是,請關注2018年1月、5月及8月國家藥監局發布的《進一步做好289基藥目錄中國內特有品種一致性評價工作有關事宜》《關于發布可豁免或簡化人體生物等效性(BE)試驗品種的通告》《關于征求289基藥目錄中的國內特有品種評價建議的通知》中的內容。這些都在提示我們,國家對一致性評價的推進不會放水,但對有些藥品的一致性評價的工作可能會有所變通。
此外,國家多份文件還提及視同通過一致性評價情況,包括“按化學藥品新注冊分類批準的仿制藥”“國內外同一條生產線生產的品種”“國外已上市同步申請國內上市”等,對于這些企業也必須予以關注或介入。
問題2 為什么說原料藥前景堪憂?
答:三個客觀原因造成原料藥可持續發展前景堪憂。
一是產業基礎。據中國醫藥企業管理協會統計報道,至2017年底,我國有原料藥品種1595種,生產批文8291個,年產量150萬噸以上,生產企業共有1616家(不包括中間體)。由于歷史的原因,不少企業生產粗放型,綠色生產水平低,環保安全不達標。
二是環境挑戰。環保要求提高,新法規、新政策不斷出臺。監督執法力度加大,中央環境保護督查,空氣質量專項督查。
京津冀大氣污染綜合治理政策頒布實施,城市化和環境容量限制倒逼去產能,限產、企業關停增多。供求關系變化,價格整體上漲,部分產品出現供應緊缺。
2018年5月25日,生態環境部發布通知表示,第一批中央環境保護督查“回頭看”將全面啟動,對河北、河南、內蒙古、寧夏、黑龍江、江蘇、江西、廣東、廣西、云南十省(自治區)開展重點督查。新一輪環保督查全面啟動,易導致部分原料藥品種高度集中在少數企業,為市場壟斷聯合調價創造了可操作空間,也將給醫藥工業上下游產業鏈帶來重大影響。
三是壟斷控銷。一些小品種原料藥被壟斷渠道,抬高價格;新“盈利模式”涉及品種越來越多。國家發改委已頒布《短缺藥品和原料藥經營者價格行為指南》文件,深信在實施中會加大監管與懲罰力度。
問題3 抗菌藥分級管理趨嚴,未來還有機會嗎?
答:2018年4月國家衛健委發布《關于印發醫療質量安全核心制度要點的通知》中18項核心制度之一就是抗菌藥物分級管理制度。文件的要求肯定會使抗生素的生產與使用繼續受到影響。
不過,企業除了需要關注其文件的精神與描述的變化外,還要關注誘導市場發生變化的其他因素。2018年上半年樣本醫院用藥市場中抗感染藥物購入總金額的增長率遠高于平均增長率,導致這個現象的原因是年初國內發生大面積流感、抗感染藥物使用增加。此外,該大類藥在樣本醫院購入藥品總金額多年來一直還是排在第一位(詳見表2)。這既說明抗感染藥物雖然在醫院使用分級管理已成常態化,但在遇到大病大災時衛生部門還是以救死扶傷為第一,允許使用臨床治療必需的抗感染藥物;又說明此大類藥物在臨床治療上療效已被醫生與患者認可,是不可缺少的。
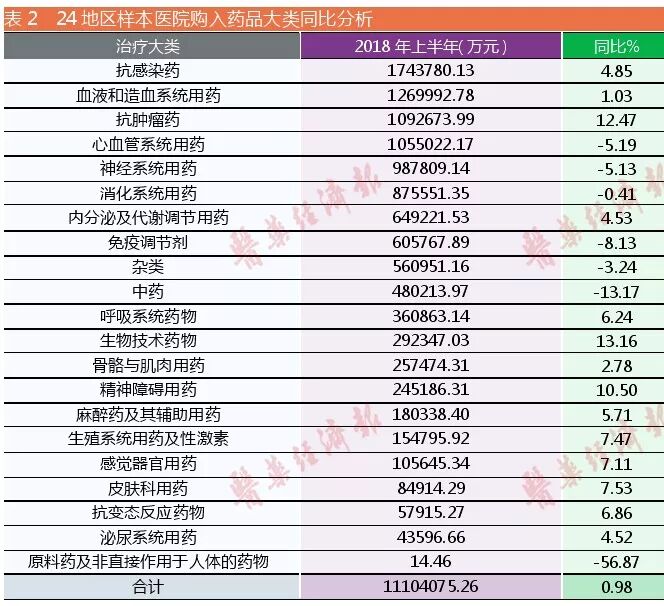
2020年,在零售藥店憑處方銷售抗菌藥達到全覆蓋,藥店如果違規銷售抗生素,將遭到最嚴查處。隨著嚴格的抗感染藥物分級管理制度的進一步實施、臨床應用管理的常態化,抗感染藥物的市場競爭肯定也會有序化,生產企業要未雨綢繆。
叁 難題討論
一致性評價的市場變局
一致性評價將推動中國醫藥行業的供給側改革。筆者認為首先要明確四個看點:加快我國從制藥大國向制藥強國邁進、制定鼓勵仿制的藥品目錄、平衡藥品創新與人民群眾健康權益、穿插整個藥品供應鏈的監管讓患者用藥安全更有保障。其次要看清未來發展趨勢,主要圍繞以下四個問題:
1 誰將“剩”者為王?
一致性評價的推進,將加速中國制藥工業去產能化,優化市場競爭格局,“剩”者為王。制藥行業進入長周期新起點,擁有優秀治療型品種的藥企最終會受益于行業變局的結構性機會。
2 大病、慢病用藥競爭格局如何改寫?
糖尿病、心腦血管疾病、乙肝等疾病領域患病人群廣泛、市場規模巨大,在人口老齡化、居民收入水平提高、健康意識提升等驅動因素下持續保持穩定增長。這些領域的主流治療藥品均有仿制藥上市,在一致性評價帶來的行業變革下,通過一致性評價的優質國產藥品在即將推行實施的國家對11城市帶量采購試點模式下,有望改寫競爭格局。
3 利好哪些注射劑?
政策利好注射劑已出口國外的國產注射劑廠家,因為這些廠家會最快拿到通過一致性評價證書并獲得價格優勢搶占市場。對應產品的競爭對手廠家未必能在3年內完成一致性評價,從而面臨批文不保的危機。
4 輔料“連坐”挑戰
如果未來部分仿制藥品種不能在規定時間內通過一致性評價,那么藥用輔料的原有需求將隨著藥品的消失而一起消失。對于輔料企業而言,這些都是在一致性評價攻堅戰中需要突圍的不小挑戰。
肆 未來變量
年底四個關注方向
關注1 政府機構架構調整
目前國務院機構已經做出了調整,組建國家衛生健康委員會、國家醫療保障局、國家監察委員會,各省各地方機構改革在2018年會陸續完成。
按照《中央關于深化黨和國家機構改革的決定》,省一級黨委政府的改革將于今年9月底前報黨中央審批,并于今年底前基本改革調整到位。所有的地方機構改革任務要在2019年3月底前基本完成。我們要關注的是新建立的各省市醫療保障局如何與目前衛健委主管的各地招標辦順利對接問題。
關注2 下半年工作重點
國務院辦公廳頒布的《深化醫藥衛生體制改革2018年下半年重點工作任務》國辦發2018(83),其中包括多項藥品政策,具體細化到50項工作。如:有序推進分級診療制度建設;建立健全現代醫院管理制度;加快完善全民醫保制度;大力推進藥品供應保障制度建設;切實加強綜合監管制度建設;建立優質高效的醫療衛生服務體系;統籌推進相關領域改革。其中,推進藥品供應保障制度建設這項工作與醫藥行業有很大的關聯性。
關注3 營銷合規
組建的國家監察委員會,被賦予憲法地位,是我國最高級別的監察機關,且此次設定的監察范圍較以往更加廣泛,傳遞了國家對懲戒腐敗態度是堅定不移與零容忍。國家下發了《關于加強衛生計生系統行風建設的意見》,按照此文件,全國大型醫院巡查繼續擴大覆蓋面和深度。2018年,三級醫療機構全部開展醫院巡查工作;2020年,二級以上醫療機構全部開展醫院巡查工作。
關注4 基層醫療市場
大衛生、大健康已經成為我國醫藥衛生改革的發展方向,正在把“以治病為中心”轉變到“以人民健康為中心”。2018年國家在降低大病診療費用,癌癥、慢病早篩等方面,將進一步出臺相關政策。此外,“處方延伸”的深入實施將使醫藥市場的格局發生變化,基層用藥市場將成為藍海。
(本文作者系國藥控股股份有限公司高級行業研究員)
信息來源:醫藥經濟報 |