嘗到甜頭后,22個品種申請上海MAH試點
日期:2018/11/24
【云端導讀】
上海市藥監局公布第三批已申請參加MAH試點的品種名單,涉及22個品種,包括上海醫藥集團申請的溴吡斯的明及片和卡馬西平片;上海復星的美洛昔康片等。不久前(10月26日),第十三屆人大六次會議決定:授權國務院在部分地方開展MAH制度試點工作的三年期限延長一年,并自2018年11月5日起施行。


11月13日,上海市藥監局公布第三批已申請參加藥品上市許可持有人制度改革試點品種名單,涉及22個品種,包括上海醫藥集團申請的溴吡斯的明及片和卡馬西平片;上海復星的美洛昔康片;揚子江藥業集團上海海尼藥業的硼替佐米及注射液和注射用比伐蘆定;再鼎醫藥的ZL-2401對甲苯磺酸鹽及制劑;上海安必生的阿托伐他汀鈣片等。

MAH制度試點延長1年
不久前(10月26日),第十三屆全國人民代表大會常務委員會第六次會議決定:將2015年11月4日第十二屆全國人民代表大會常務委員會第十七次會議授權國務院在部分地方開展藥品上市許可持有人制度試點工作的三年期限延長一年。本決定自2018年11月5日起施行。
MAH制度的緣起及意義:藥品批文的產權革命
2015年11月,全國人大常委會授權國務院在北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川10個省市開展藥品上市許可持有人制度試點。
2016年6月,國務院辦公廳發布《關于印發藥品上市許可持有人制度試點方案的通知》(以下簡稱《通知》),明確試點內容、試點品種范圍、持有人條件、持有人義務與責任等。
根據《通知》,試點行政區域內的藥品研發機構或者科研人員可以作為藥品注冊申請人,提交藥物臨床試驗申請、藥品上市申請,申請人取得藥品上市許可及藥品批準文號的,可以成為藥品上市許可持有人。法律法規規定的藥物臨床試驗和藥品生產上市相關法律責任,由申請人和持有人相應承擔。
這意味著不具備藥品生產資質的科研機構、甚至自然人(科研工作者)都可能依法持有藥品批文。
對于持有人不具備相應生產資質的,須委托試點行政區域內具備資質的藥品生產企業生產批準上市的藥品。持有人具備相應生產資質的,可以自行生產,也可以委托受托生產企業生產。這一規定,既解決了持有人的生產問題,也使得多點委托生產成為可能。
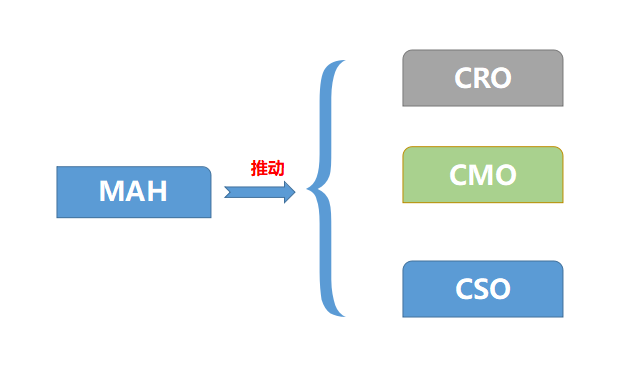
MAH制度推動醫藥外包服務CRO、CMO、CSO的蓬勃發展
上市許可持有人(MAH)制度最大的意義在于讓醫藥市場要素靈活的流動,不具備藥品經營生產和經營資質的機構和個人只要有創新能力,都可以持有藥品批件,通過委托授權其他生產企業生產或銷售經營企業來進行銷售,而不是過去將批文綁定在生產企業,這也促進了醫藥服務外包的三種形式:上游發研發外包CRO、生產外包CMO、營銷外包CSO。
國內已有企業獲益
2016年12月27日,齊魯制藥有限公司研發的首仿藥品吉非替尼經CFDA批準取得上市許可持有人文號,成為中國首個藥品上市許可持有人制度(MAH)試點品種。
2017年3月27日,浙江醫藥股份有限公司的蘋果酸奈諾沙星原料藥及其膠囊劑(商品名太捷信)經CFDA批準取得了藥品上市許可持有人文號,這是我國藥品上市許可持有人制度試點實施以來,獲批的首個創新藥。
得益于MAH制度,原本不具備藥品生產資質的上海安必生制藥技術有限公司,繼獲得上海市第一個MAH產品批件后,2018年10月9日又獲得了該市首張藥品研發企業上市許可人營業執照,經營范圍為“藥品委托生產(詳見藥品上市許可持有人藥品注冊批件)” 。

MAH制度的實施,將是醫藥行業的一次產權革命,能夠提高藥品研發機構和科研人員創新積極性,促進醫藥產業供給側改革,提升產品質量,抑制低水平生產企業重復建設。
|