以嶺藥業兩抗癌藥獲FDA批文,是否有意“彎道超車”?
日期:2018/11/24
【云端導讀】
以嶺藥業兩產品相繼獲得FDA審批通過,分別是阿那曲唑片和來曲唑片,其適應癥同為乳腺癌治療。本次獲得FDA批文,標志著其具備在美國市場銷售該產品的資格,對其拓展美國市場帶來積極影響。而以嶺是否有意借海外共線產品這條“捷徑”來實現通過一致性評價,目前還只是猜測。

11月17日,以嶺藥業發表公告,其全資孫公司制劑產品來曲唑片獲得美國FDA批準文號,而前兩天,11月15日,以嶺孫公司的另一制劑產品阿那曲唑片也已獲得美國FDA審批。兩天時間以嶺藥業有兩個制劑產品相繼獲得FDA審批通過,且適應癥同為用于乳腺癌治療。
以下為該兩品種的具體信息:
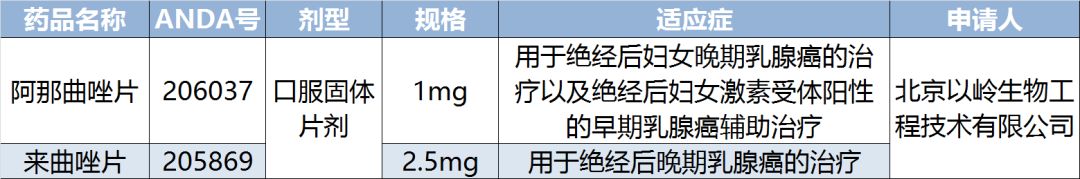
關于阿那曲唑片:
阿那曲唑片適用于絕經后婦女晚期乳腺癌的治療以及絕經后婦女激素受體陽性的早期乳腺癌輔助治療。阿那曲唑片由ANIPHARMACEUTICALSINC研發,于1995年在美國獲批上市。
當前,美國市場阿那曲唑片主要生產商為ACCORDHEALTHCARE和TEVAPHARMACEUTICA、BLUEPOINTLABS等。IMS數據顯示,2017年6月-2018年6月阿那曲唑片1mg美國市場銷售額約1577萬美元。截至目前,該企業在阿那曲唑片研發項目上已投入研發費用294萬元人民幣。
關于來曲唑片:
來曲唑片用于絕經后晚期乳腺癌的治療。來曲唑能有效抑制雄激素向雌激素轉化,選擇性較高,具有較高的治療指數。與其他芳香化酶抑制劑和抗雌激素藥物相比,來曲唑的抗腫瘤作用更強。來曲唑片由NOVARTISPHARMACEUTICALSCORP(諾華)研發,于1997年在美國獲批上市。
當前,美國市場來曲唑片主要生產商為ACCORDHEALTHCARE和TEVAPHARMACEUTICA、BRECKENRIDGE等。IMS數據顯示,2017年7月-2018年6月來曲唑片2.5mg美國市場銷售額約1622萬美元。截至目前,該企業在來曲唑片研發項目上已投入研發費用251萬元人民幣。
本次阿那曲唑片和來曲唑片兩個產品獲得美國FDA批準文號,標志著北京以嶺生物工程技術有限公司具備了在美國市場銷售該產品的資格,將對其拓展美國市場帶來積極的影響。企業將積極推動該產品在美國市場的上市準備。
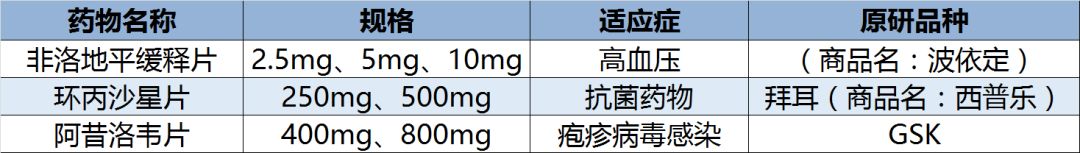
目前以嶺藥業已有5個制劑產品獲得FDA批文:
據悉,此前,以嶺藥業在今年10月、6月和3月還有三個制劑產品獲得美國FDA的批文:抗菌藥物的環丙沙星片以及皰疹病毒感染藥物的阿昔洛韋片。
以嶺藥業作為一個以專利中藥為基礎的特色企業,近年來也開始積極布局化藥產業,構建專利中藥和化藥兩方面協同發展、相互促進的產業格局。
據企業公告信息顯示,在化藥仿制藥業務方面,目前該企業已向FDA遞交了九個ANDA申請,其中以上三個制劑產品以通過審批獲得美國上市資格,部分產品已成功銷往美國市場;同時多個化學一類新藥的研發工作。
另外,在合同加工業務方面,以嶺藥業是國內出口制劑規范市場規模較大的企業之一,產品已出口至英國、加拿大、新西蘭、德國、澳大利亞等多個國家和地區。
近年來鑒于國家對中藥產品的監管趨嚴,相關企業已感受到政策帶來的壓力,開拓多方面產品協調發展成為其謀求發展的有效出路。
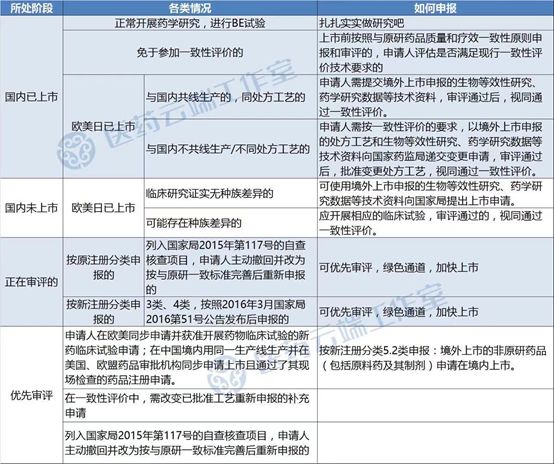
而從另一個角度考慮,以嶺藥業如此積極斬獲FDA文號,是否有意借歐美獲準上市的制劑產品走海外共線生產這條“捷徑”實現“彎道超車”,來通過通過一致性評價?目前還只是猜測,畢竟上述五個品種目前尚無廠家通過一致性評價。
通過一致性評價的“四條捷徑”
信息來源:醫藥云端工作室 |